14 中学で覚えるイオン、酸とアルカリ
2011年10月下旬、普通教室
今日は、テスト対策用に中学で覚えておくと良いイオンを20個取り上げます。それと同時に、テスト後に学習する酸とアルカリについて要点だけまとめまておきます。
本時の目標
(1) 中学2年までに学んだ酸とアルカリについて復習、まとめる
(2) 中学で覚えるイオン20個を知り、覚える
授業の流れ
| 1 酸とアルカリの復習(12分) 2 水素イオンと水酸化物イオン(3分) 3 PH、水素イオン濃度について(5分) 4 イオンの周期表の復習(5分) 5 中学で覚えるイオン20個の紹介(15分) 6 生徒個人による、本日のまとめと復習(10分) |
授業の内容
(1) 中学2年までに学んだ酸とアルカリの復習、まとめ(17分)
| 酸 性 | 中 性 | アルカリ性 |
| ・なめると酸っぱい | . | ・さわるとぬるぬるする |
| ・金属を入れると、 水素を発生することが多い |
||
| ・塩 酸(HCl) ・硫 酸(H2SO4) ・硝 酸(HNO3) ・炭 酸(H2CO3) |
・水酸化ナトリウム(NaOH) ・水酸化カリウム(KOH) ・水酸化カルシウム(Ca(OH)2) ・水酸化バリウム(Ba(OH)2) |
|
| BTB→ 黄 | BTB→ 緑 | BTB→ 青 |
| リトマス→ 赤 | リトマス→ 変化なし | リトマス→ 青 |
| フェノールフタレイン→ 無色 | フェノールフタレイン→無色 | フェノールフタレイン→ 赤 |
| ・酸の正体は 水素イオン(H+) |
・酸とアルカリをまぜるとHOH(H2O)水ができる | ・アルカリのの正体は 水酸化物イオン(OH-) |
以上は、さらさらーっと行います。
(2) 中学3年で学ぶ水素イオンと水酸化物イオン(3分)
中学3年で学習するのは、上記表の最終行にある内容だけ。非常に簡単。なお、PH(ピーエッチ)については、別にまとめる必要がありますが、これもさらっと行うことが肝心です。
(3) PH(水素イオン濃度)について(5分)
「PHは、酸やアルカリの度合、強さを示すときに使うものです。ところで、すでにPHを知っている人も多いと思うので、中性ときの数値を聞いてみましょう。中性のときのPHの値を知っている人? ・・・正解、7です。そして、酸性のときはPH7より大きくなりますか小さくなりますか? ・・・その通り、7より小さくなると酸性、7より大きくなるとアルカリ性になります。もちろん、小さければ小さいほど酸性が強くなり、大きければ大きいほどアルカリ性が強くなります。以上を、簡単にプリントにまとめておきましょう。
| 酸 性 | 中 性 | アルカリ性 |
| 0 ← | PH7 | → 14 |
補足ですが、最高に強い酸は1ではなく、0でもなく、0未満のマイナスになります。アルカリも14より大きくなりますが、実は、PHを正確にはかることはとても難しいので、とりあえずの範囲は0から14までにしておきます。教科書や参考書によって違うこと、を知っていることの方が重要です。ただし、中性は水素イオン濃度を表すもので、水酸化物イオンとは関係ありません。は必ずPH7です。それから、PHは正式に
(4) 水素イオン濃度イオンの周期表の復習(5分)
原子番号1番から20番までの原子について、イオンになったときの電気量をプラスマイナスを、原子の周期表通りの位置に書かせます。これは、少ないクラスで2回、多いクラスで4回書いているので、5分あれば十分です。メインは、1番から20番までで、入試に出ないものに×をつけること。その逆に、出題されるものを追加することです。その実際は、次の(5)をご覧ください。これが本日のメインです。
(5) 中学で覚えるイオン20個の紹介(15分)
| H+ 水素イオン (酸) |
. | . | . | . | . | . | He |
| . | . | . | C | N3- 窒 化物イオン |
O2- 酸 化物イオン |
. | Ne |
| Na+ ナトリウム イオン |
Mg2+ マグネシウム イオン |
Al3+ アルミニウム イオン |
Si | .. | S2- 硫 化物イオン |
Cl- 塩 化物イオン |
Ar |
| . | Ca2+ カルシウム イオン |
. | . | . |
|
|
. |
| Ag+ 銀イオン |
Zn2+ 亜鉛イオン |
. | . | . |
|
|
. |
|
|
Cu2+ 銅イオン |
. | . | . | . | . | . |
| . | Fe2+ 鉄イオン |
. | . | . | SO42- 硫酸イオン |
OH- 水酸 化物イオン (アルカリ) |
. |
| NH3+ アンモニウム イオン |
Ba2+ バリウム イオン |
. | . | . | CO32- 炭酸イオン |
. | . |
※炭色は、原子番号1番から20番までの位置
※青色は金属(金属は必ずプラスイオンになる)
※金属のほとんどは、2プラスのイオンになる
※黄色は、いくつかの原子が集まって1つのイオンになったもの
※酸は水素イオン、アルカリは水酸化物イオン
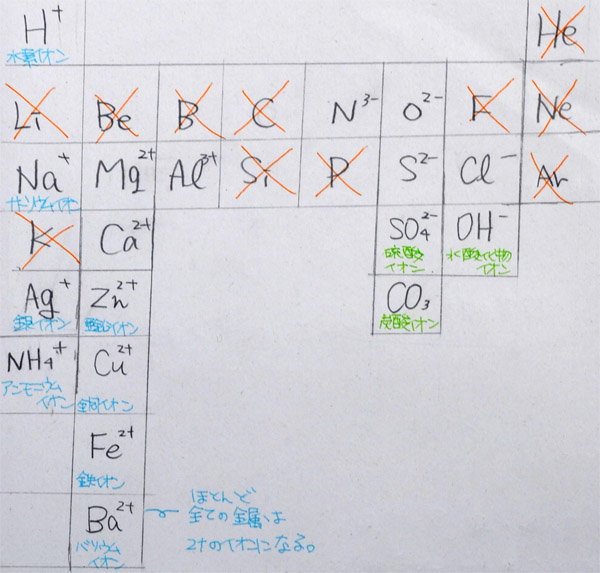
上:Aさんの学習プリント
(6) 生徒個人による、本日のまとめと復習(10分)

上:時間があまったクラスで行った内容『イオンを組み合わせて化合物をつくろう』

上:同上。化学式、イオン式、分子式、化学反応式、電離式、および、分子について簡単に説明している。
| 化学式 | ・原子の記号で物質を表したもの ・分子式(化学式の中でも、とくに分子をあらわしたもの) |
| イオン式 | ・イオンを記号で表したもの ・原子1個 〜 数種類の原子が複数集まったもの |
| 化学反応式 | ・原子の組みかえ(初めの物質がなくなる)化学反応を表したもの ・化学変化を示す『→』をいれる ・電離式(化学反応式の中でも、とくに初めの物質が2つのイオンになる式を表したもの) |
授業を終えて
中学で学ぶべきものをテスト前に明確にするのは、生徒にとって嬉しいのではないかと思います。中でも、たくさく覚えたものの中から、不要なものを削除するのは楽しい作業になるはずです。必要ないことを覚えることは無駄ではなく、それは必要な無駄です。それは本物の『ゆとり』であり、人生を豊かにするものです。そもそも、原子記号なんか知らなくても日常生活に大きな支障はないけれど、知っているか知らないかは、自然に対する見方を1つ知っているか知らないかという、別次元の世界を知っているか知らないかの違いです。当然、知っている人の方がゆとりがあるわけです。無駄な学習を楽しむような生徒、知的な楽しみがあることを気づかせたい、知的な興奮を味あわせたい、といつも思っています。
|
塩化銅の電気泳動 |
電離式の小テスト |