18 HClとNaOHの中和
2011年11月上旬、理科室
中和反応といえば、この塩酸と水酸化ナトリウム水溶液の反応です。中学卒業までに、化学反応式も含めてしっかり覚えて欲しいものです。実験内容も楽しいので、印象深く学習できると思います。
ちょいネタ
塩酸は塩化水素水溶液のニックネームです。したがって、この表題のように『HClとNaOH』、あるいは、『塩化水素と水酸化ナトリウム』や『塩化水素水溶液と水酸化ナトリウム水溶液』とすると、酸とアルカリのバランスがとれます。多くの教科書は、『塩酸と水酸化ナトリウム水溶液』としていますが、私はバランスの悪いので好きではありません。関連ページ
塩酸と水酸化ナトリウムの中和(1年)2002年
実験12 塩酸と水酸化ナトリウムの中和(3年)2001年
↑BTB液液の扱い方が詳しく書いてあります
本時の目標
(1) HClとNaOHの中和反応式を正しく理解する
(2) 中和は、必ず塩(えん)と水ができることを理解する
(3) BTB液を使って、HClとNaOHを完全に中和実験させる
(4) 食塩の結晶をつくり、観察する
授業の流れ
| 1 本時の目標を知る(2分) 2 HClとNaOHの中和反応式を正しく理解する(3分) 3 中和は、必ず塩(えん)と水ができることを理解する(5分) 4 実験手順を知る(5分) 5 実験する(25分) 5 片付けて、考察する(10分) |
授業の様子
1、2 HClとNaOHの中和反応式を正しく理解する(5分)
本時の目標を話してから、黒板に(塩酸)+(水酸化ナトリウム)まぜる→中和(・・)(・・)を書く。そして、「先着2名程度、書きたい人お願いします!」と言えば良い。その後、反応式を確認し、一般的な中和反応についてまとめる。

上:黒板に、化学反応式を書く生徒
3 中和は、必ず塩(えん)と水ができることを理解する(5分)
化学反応の結果できる物質は、初めの物質の内側と内側、外側と外側を組み合わせたものになる。まず、内側と内側をあわせて、NaCl(塩化ナトリウム、食塩)ができる。次に、外側と外側をあわせて、H2O(水)ができる。内側と内側をあわせたものは塩(えん)というが、この中和反応では地球の海水に大量に含まれる食べられる塩、食塩ができる。完全な中和を行えば飲むことができるが、絶対に試してはいけない。
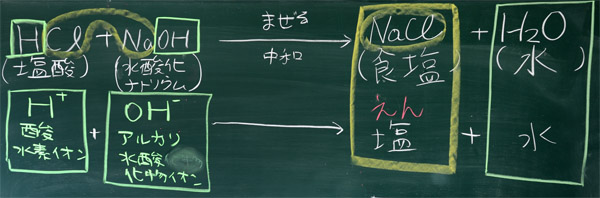
上:板書
4、5 実験の様子(25分)
 |
. |  |
上左:左手前の赤い水溶液が塩酸、中央の黄色は混合液、右奥の青いものは水酸化ナトリウム水溶液。スポイトを使って、塩酸と水酸化ナトリウム水溶液を混合し、緑色の食塩水をつくる。なお、塩酸が赤く見えるのは、塩酸の濃度が高いからである。水を加えると、黄色になる。
上右:緑色になった食塩水1滴をスライドガラスに載せ、弱火で加熱し、水を蒸発させる。加熱速度が速く、スライドガラスを割る生徒の割り合いは5%。割れた破片が目に入るような大事故を起こさないように、十分な注意を促すこと。

上:スライドガラスにできた食塩の結晶を探す。BTBを加えたので、形のよいものを探すためには数分程度の時間がかかる。
授業を終えて
中和は1滴勝負なので、なかなかできない。生徒は非常に楽しんで実験している。
|
HClとNaOHの電気泳動 |
H2SO4とBa(OH)2の中和 |