== 中和反応と塩(えん) ==
<本時の狙い>
1 最も簡単な中和反応につて理解を深める
HCl + NaOH → H2O + NaCl
(理解できない生徒については丸暗記)
2 入試の出る中和反応は次の2つであることを知らせ、理解
させる
1) 塩酸と水酸化ナトリウム(上記)
2) 硫酸と水酸化バリウム
H2SO4 + Ba(OH)2 → 2H2O + BaSO4
3 中和反応によってできる塩は、規則正しく考えることによ
って求められることを気づかせる(全員)
4 理解度の高い生徒には、プリントで求めた塩の中和反応式
を書かせ、係数の理解を深めさせる
<教師の準備>
自作プリント
<授業の流れ>
1 自作プリントを配り、本時のねらいを知らせる
2 「最も代表的な中和反応何か?」と発問し、次の反応式を
確認する
HCl + NaOH → H2O + NaCl
<板 書>

3 水素イオンと塩化物イオンについて確認する
4 『塩』について確認する
塩とは、中和反応で残ったもの (←ただし、適切ではない)
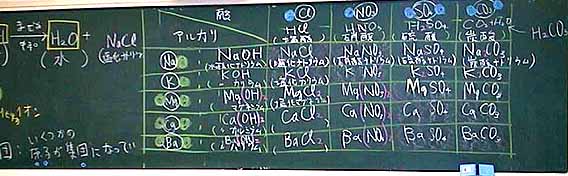
5 プリントの『酸』を記入させる
・ 教師が、塩酸、硝酸、硫酸、炭酸、酢酸を板書する
・ 生徒が、その化学式を記入する
6 『酸』の分子モデルを教師が確認する
・ 水素イオンの色は、赤とする
・ 硝酸のところで『原子団』について知らせる
原子団とは、いくつかの原子が集団で1つの働きをするもの
・ B組では、炭酸を上図のように表現した。これについては、
そのまま消さずにおき、原子の数が同じであることを確認さ
せた。
7 『アルカリ』について
・ 教師が、水酸化ナトリウム、水酸化カリウム、水酸化マグ
ネシウム、水酸化カルシウム、水酸化バリウムを板書する
・ 生徒が、それらの化学式を記入する
・ 教師が、それらのモデルを示す
8 それらの酸、アルカリによってできる『塩』を記入させる
・ 興味の無さそうな生徒を指名し、塩酸の列を全て答えさせる
・ その時、塩素が2個になる場合については触れない
・ 暫くしてから、理解が不足していそうな生徒を指名し、
硫酸マグネシウムについて答えさせ、板書する
9 陽イオン、陰イオンの数について合わせる
・ 塩酸の列について、塩化マグネシュウムから順に、
水素イオンと水酸化物イオンの数に着目させる
・ 第2列、硝酸については、NO3全体をカッコで括ることを
再確認する
<板 書>
==<生徒の様子>==================
1 HCl + NaOH → H2O + NaCl
については、ほとんど理解できていた
2 原子団の理解度は、初めてであったが良好
3 H2SO4 + Ba(OH)2 → 2H2O + BaSO4
については、係数が分からない生徒が5、6名
4 『規則的に塩を求める』ことは全員できた
5 理解度の高い生徒には、塩の中和反応式を書かせたが、
係数の確認をする時間がなかったことが残念である。
===========================
<本時の考察>
・ 教科書では『原子団』の概念を扱っていないが、
これを押さえることで理解度は飛躍的に増した
・ 水素イオンと水酸化物イオンのモデルについては、
教師の工夫が、今1つと感じた。
[→home]
(c) 1999 fukuchi takahiro
(以下余白)