13 塩化銅の電気泳動
2011年10月中旬、第2理科室
学校で使っている問題集に、『塩化銅水溶液の電気泳動』の問題があったので、それを実験することにしました。この問題は、2学期中間テストの範囲なのですが、やってみなければさっぱりわからない感じなのです。
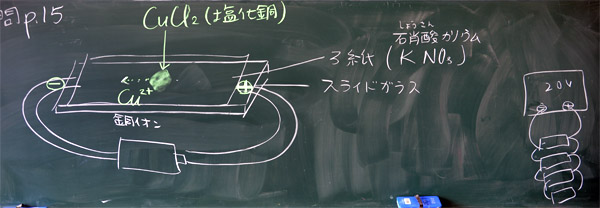
| 問 題 硝酸カリウム水溶液の水溶液で湿られたろ紙の上に、塩化銅水溶液を1滴のせ、その両端にプラスとマイナスの電圧をかけるとどうなるか。 |
授業の流れ
1 今回のテスト範囲について確認する(1分)
2 問題文を読む(1分)
3 硝酸カリウムについて解説する(1分)
4 実権手順を解説する(5分)
5 生徒実験(30分)
6 片づけ(7分)
上:とあるクラスでの板書
taka先生のお話
1 硝酸カリウムについて
「中間テストの範囲の確認をします。問題集は・・・(中略)・・・。では、問題集15ページの問題をやります。問題を読んでくれる人はいませんか。・・・A君。」・・・「硝酸カリウムは何のために使うのかわかる人? ・・・ 誰もいないだから、ヒント! 水の電気分解では何かを入れたと思うけれど何だった? そうですね。水酸化ナトリウムです。・・・(中略)・・・ということで、それと同じように電流を流しやすくするために、今回は硝酸カリウムを使う、というわけです。」
2 銅イオンはマイナス極へ移動する
「次に、全員にカッコ2の問題に答えてもらいます。銅イオンはマイナス極へ移動しますか。それともプラス極へ移動しますか。答えは50%50%です。どちらかに手を挙げてください。では、マイナス極だと思う人! ・・・正解!! 銅イオンはプラスの電気を持っているので、マイナス極へ移動します。」(と言いながら、黒板に銅イオンが移動する矢印を書く。これで問題は解けるようになる。第一目標達成。だけれど、こんなに簡単にわかるようになるのは、これから実験で実際に試してみようとしながら問題を読んだり解説したり考えたりするからです。
3 実験テクニックの解説
「他のクラスの様子から、いくつかの工夫を紹介します。まず、塩化銅水溶液の濃さや量が大切なのですが、単純な濃度の条件だけでは決まらないので、濃さが違う2種類の水溶液を用意しておきます。好きな方を使ってください。上手くできなかったら、その様子を見てやり直してください。2回チャレンジすれば、良い結果が得られます。また、塩化銅の粉も用意しておきますので、それを使っても構いません。スライドガラスの中央に載せ、しばらくすれば、水分を吸ってとけてきます。ただし、いずれも場合も塩化銅は有毒なので注意してください。」
「また、4人班の場合は、電源装置を並列つなぎにすれば4人同時にできるので、自分のものは自分でやりましょう。そして、できたものはプリントに添付すること。銅イオンが移動した様子がよくわかるものは、もちろん、実験技能ポイントAを差し上げます。では、実験始め!」
生徒実験の様子

上:塩化銅水溶液をろ紙の上につける生徒。

上:画面手前に、手順説明のために私が演示してつくった見本がある。
左の200mlビーカーは硝酸カリウム水溶液(硝酸カリウム80gに水をいっぱいいれたもの。溶け残っているが、飽和している方がよい結果が出る。)

上:電源装置につないで、銅イオンが移動する様子を観察する生徒。

上:青い銅イオンがマイナス極(左)へ移動している。赤い端子はプラス極。

上:塩化銅の粉末で試したもの。

上:ジャンケンで、より良い実験結果を選ぶ生徒達。

上:実験結果をプリントに添付するB君。
彼が添付しているのは万能リトマス紙による実験。これについては、別ページで解説する。お楽しみに!
授業を終えて
教科書にある実験をやるのはもちろんだけど、問題集にある実験をやるのはとても楽しいよ。全然理解度が違うし、違うことをやっているというワクワク感が違う。それに、問題も実験もやってみなければわからないからね。
|
5つの金属のイオン化傾向 |
中学で覚えるイオン、酸とアルカリ |