12 5つの金属のイオン化傾向
2011年10月中旬、第2理科室
この授業は2011年現在、日本の中学生用の検定教科書に記述されていない内容です。しかし、金属のイオン化傾向を簡単に教えるものとして、大変有効なものです。小学生でも実験し、まとめ、考察できるような内容です。2015年頃のマイナーチェンジでは、全ての教科書に掲載されることを希望する内容です。全国の中学の先生は、どうぞお試しください。もちろん、金属のイオン化傾向を教える必要があるのか、という問題がありますが、目的は『イオン化傾向がある』という事実を実験で確かめることです。さもなければ、亜鉛と銅で化学電池をつくった時、亜鉛が−極、銅が+極になる理由を全く説明できませんからね。実のところ、私は化学電池でいろいろな金属を調べることを学習内容から削除するべきだと思っていますが、現状ではイオン化傾向まで調べなければ消化不良の理科嫌いをつくる結果になるので、楽しくイオン化傾向の存在を確かめる必要があります。
1 今日の目標
(1) 塩酸に対する金属の溶け方を調べる
(2) (1)の違いから、金属のイオン化傾向を推測する
2 授業の流れ
(1) オープニング(3分)
「金属は塩酸に溶けることは、これまで何回も実験してきました。とくに良く溶けるのはマグネシウムでした。今日は、いろいろな金属を溶かし、その溶け方の違いを調べてみましょう。そして、溶けやすさの順に並べてみましょう。調べる金属は、アルミニウム、亜鉛、鉄、マグネシウム、銅の5つです。1つだけ溶けない金属がありますが、塩酸に入れれば、すぐにわかります。」
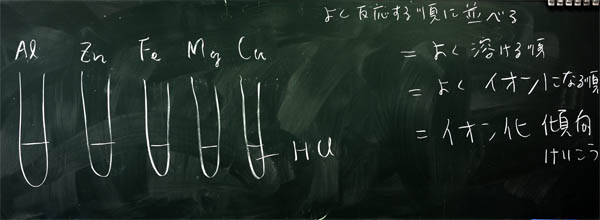
上:あるクラスでの板書
(2) 金属の溶け方とイオン化傾向(2分)
「塩酸に溶けないということは、イオンにならないということです。良く溶けるということは、よくイオンになるということです。つまり、金属の種類によって、イオンへのなりやすさが違うということです。イオンになる、イオンになりやすさの性質をイオン化傾向といいます。化学電池では2種類の金属を使いましたが、溶けやすい金属、すなわち、イオン化傾向が大きい金属が溶け、−極になります。今日は5種類の金属のイオン化傾向を調べるだけにしますが、この順序を知っていれば、どのような金属2種類を組み合わせても、どちらが+−になるか、理論的にわかるわけです。」
(3) 実験方法の解説(5分)
「試験管を5本用意し、試験管立てに並べます。そして、塩酸を1/5入れてください。塩酸は約20%にしたもの、比較的濃いものを使いますので、手についた時は速やかに10秒間水で洗い流してください。すぐには何も感じない人がほとんどですが、そのままにすると赤くなったり痛くなったりします。さて、ここに5種類の金属を入れますが、1つ問題があります。それは、金属の形状、形や状態が違うことです。同じ形状なら、誰でも簡単に溶けやすさの順に並べられるのですが、残念ながら全て違います。銅とアルミニウムは1センチ四方の板ですが、マグネシウムは薄っぺらなマグネシウムリボン、亜鉛は複雑な形をした塊、鉄はスチールウールを使います。アルミニウムはアルミホイルを使っても良いでしょう。アルミホイルは表面積が大きいので、板状のものよりよく溶けるように見えます。また、スチールールは最も表面積が大きいので誤魔化されないようにしてください。さらに、不純物を含んでいるので臭いガスを発生させます。有毒ガスも出るので、結果がわかったら塩酸から速やかに取り出してください。塩酸は水道水に捨てて構いません。それでは、実験始め!」
(4) 生徒実験(30分)

上:反応速度が速く、発生した水素で浮いてしまった金属をガラス棒で調節する生徒

上:左から、銅、鉄(スチールール)、亜鉛、アルミニウム、マグネシウム(すべて溶けてしまった)

上:別の班の様子。左から、亜鉛、銅、マグネシウム、鉄、アルミニウム

上:試験管が傾いているので不思議だったのですが、塩酸の量を同じにしようとしていたようです。

上:手にとって、反応速度について意見を出し合う生徒達

上:発生した気体を上方置換法で集める生徒

上:マッチの炎を近付けると、酸素と激しく化合して爆発する。
(5) 5種類の金属のイオン化傾向(2分)
| マグネシウム | 鉄 | 亜 鉛 | アルミニウム | 銅 |
|
|
|
|||
| イオンになりやすい ← イオン化傾向(大) |
→ イオンになりにくい イオン化傾向(小) |
|||
(6) 片づけ、考察(8分)
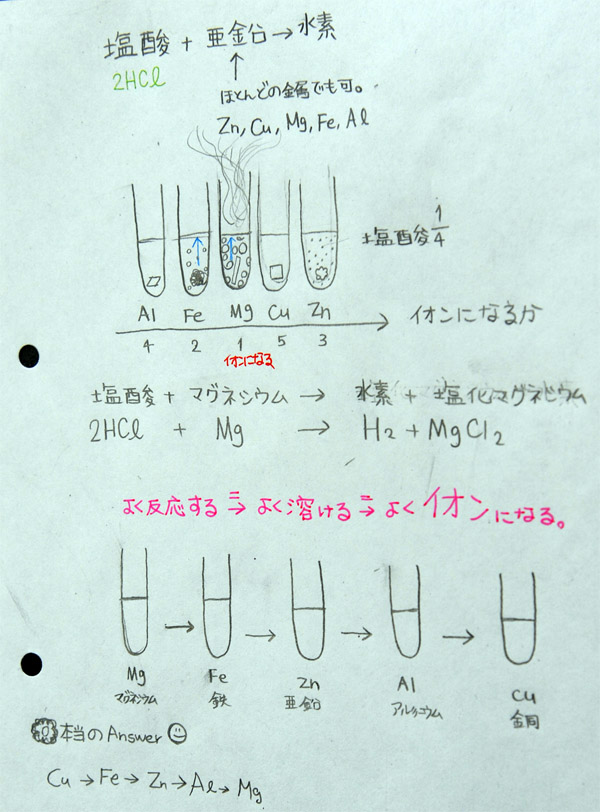
上:Aさんの学習プリント
taka先生の予備実験
 |
. |  |
. |  |
. |  |
. |  |
左から、マグネシウム、鉄、亜鉛、アルミニウム、銅。ちょっと塩酸が薄すぎたようです。
授業を終えて
とても簡単な実験で、金属のイオン化傾向を説明できることがお分かりになったと思います。この実験は、亜鉛と銅を使った化学電池だけでなく、イオンに関するさまざまな問題を解くときの鍵になります。「5種類の金属を塩酸にとかした時を思い出してごらん。」と言えば、生徒は「うんうん」「あ、そうだった」といって納得します。どうぞお試しください。