11 化学電池のしくみ
2011年10月中旬、普通教室
10月下旬の2学期中間テスト対策を兼ねて、問題集p.18の10番『化学電池』の問題を20分ほどかけて解きました。この問題は、今回のテスト範囲(問題集の中)で最上級に難しいものの1つなので、これができれば自信をもってテストに臨めるはずです。残りの時間は、友達どうしで教えあったり、各自でテスト対策をしたりする時間にしました。
1 今日の目標
(1) 2学期中間テストのテスト範囲とポイントを確認する
(2) 問題集を使って、化学電池のしくみをまとめる
2 授業の流れ
(1) テスト範囲の確認(8分)
テスト範囲は、1人ひとりに配付された『テスト範囲表』に印刷されてあることだけど、生徒からいろいろ質問が出るから、結構時間がかかります。出題される問題を聞き出そうとしているのは分かるのですが、そう簡単に出ることはありません。言ってしまったように見せかけて勉強させることはありますけど。
(2) 本日考える問題を読む(2分)
|
※上の問題は、オリジナルの問題を私が改良したものです。順番に解き進めることで、どの段階でつまづいているのか、わかるようにしました。以下は授業の手順とは違いますが、この問題を一緒に解いてみましょう。きっと、化学電池のしくみが理解できるようになると思います。2種類の金属板をそれぞれ単独で入れた場合と、2種類の金属板をつないで化学電池にした場合で、水素が発生する金属板が逆になることが理解できれば合格です。
(3) クラス全員で問題を解く(20分)
塩酸の中に、亜鉛板を銅板を入れた。 |
『塩酸と金属で水素をつくる実験』は、小学校で行った生徒が多数いました。塩酸に亜鉛を入れて水素をつくるのは、とてもオーソドックスな実験です。中学2年生では、亜鉛の代わりにいくつかの金属を使って、水素を発生させた生徒もいます。一般的に、『酸に金属を入れると、水素が発生する』と覚えている生徒もたくさんいます。ただし、銅は塩酸と反応しないことは、中学3年で学ぶ生徒がほとんどです。なぜ、銅が反応しないのか? 私は、その理由を説明するために、『イオン化傾向』の実験をすることにしました。次の時間に行います。お楽しみに! あ、問題(1)の答えは『亜鉛板』です。
(2) (1)の金属板はどうなるか? |
亜鉛板は、塩酸に溶けます。なくなるように見えますが、実際はどうなるか? その問題と答えが(3)です。
(3) (1)の金属板を構成する原子はどうなるか? |
亜鉛板を構成する亜鉛原子は、ばらばらになり、塩酸の中へ溶けていきます。ばらばらになるとき、亜鉛原子のままではなく、プラスの電気を帯びた亜鉛イオンになります。なぜ、プラスになるのかは覚えるしかありません。亜鉛に限らず、すべての金属はプラスイオンになります。そもそも、プラスイオンになる原子を『金属』といい、金属は原子の大半を占める原子です。ということで、原子はプラスイオンになって水溶液に溶けます。また、プラスイオンになるとき、マイナスの電気を帯びた『電子』を亜鉛板においていきます。1つの亜鉛原子がおいていく電子の数は2個です。これも覚えるしかありません。
(4) (1)の金属板の表面で、水素が発生するときの化学反応式を書け。ただし、電子は『e-』で表すこと。 |
水素イオン2個(2H+) + 電子2個(2e-) → 水素分子1個(H2)
突然、難しくなりましたか? 難しくなったとすれば、次の点を復習しましょう。
(ア) 水素イオンは、H+です。
(イ) 水素イオンは、プラスの電気を帯びた水素原子です。
(ウ) 水素イオン2個は、2H+です。
(エ) 水素原子2個は2Hですが、水素としての性質はもっていません。
(オ) 一般に『水素』というとき、それは水素の性質をもつ『水素分子』をさしています。
(カ) 水素分子は、H2です。
とうことで、水素イオン2個に電子2個をあげると、水素分子1個になります。これを肉眼で観察すると、水素の泡がぶくぶくと発生するように見えるわけです。
 |
. |  |
上左:塩酸の中にある亜鉛。その表面から水素分子が発生している。同時に、亜鉛はその姿を失い、塩酸(塩化水素の水溶液)の中に溶けていく。亜鉛原子はなくなるのではなく、肉眼では見えない小さな亜鉛イオンになって水溶液中に存在する。
上右:塩酸の中にある銅。変化なし。その理由は、次の時間に実験しながら調べる。
次に、亜鉛板と銅板に導線をつけ、モーターにつなげた。この化学電池について、以下の問いに答えよ。 |
亜鉛板から、水素は発生しません。なぜなら、亜鉛板に残された電子は、すぐさま導線を伝わって移動するからです。本体を失ってしまった亜鉛板にとどまるのではなく、とても素早く移動します。抵抗ゼロの場合、光速で移動するので、水素を発生している時間がありません。実際の実験ではこのようにうまくいきませんが、理論的には亜鉛板から水素は発生しません。水溶液中の『水素イオンにあげるための電子』がないからです。
(6) (1)の金属板はどうなるか? |
亜鉛板は、溶けます。これは前と同じです。
(7) (1)の金属板を構成する原子はどうなるか? |
亜鉛原子は、電子2個をおき、亜鉛イオンになって水溶液へとけていきます。これも同じです。
(8) マイナス極はどちらの金属板か? |
マイナス極は、電子がある方です。したがって、亜鉛板がマイナス極です。
(9) マイナス極にできた電子は、どうなるか? |
前に述べたように、電子は導線を通って銅板へ移動します。その途中、モーターがあれば、モーターを回します。
(10) 水素が発生するのは、どちらの金属板か? |
水素が発生するのは、銅板です。銅板にたくさんの電子が移動してくるからです。移動してきた電子は、水溶液中の水素イオンと結びつくようにして、水素分子の一員になります。こうして、銅板の表面で水素が発生します。なお、銅板そのものは全く変化しません。
化学電池のつくり方 |
||
| . | ||
 |
 |
|
上右:カルピスでつくった化学電池かな。2mA程度の電流がでてきいます。
※(『フルーツ電池/3年理科/takaの授業記録2011』から)
(3) 友達との学習、自学自習の時間(20分)
残りの時間は、友達に教えたり教えてもらったり、あるいは、自分だけでまとめたりする時間にしました。難しい内容を学習したときは、このような自由な時間をつくることで、理解度が数段階アップします。友達に教えること、自分の疑問を明確にして質問すること、自分の言葉で書直すことは、とても重要な作業です。
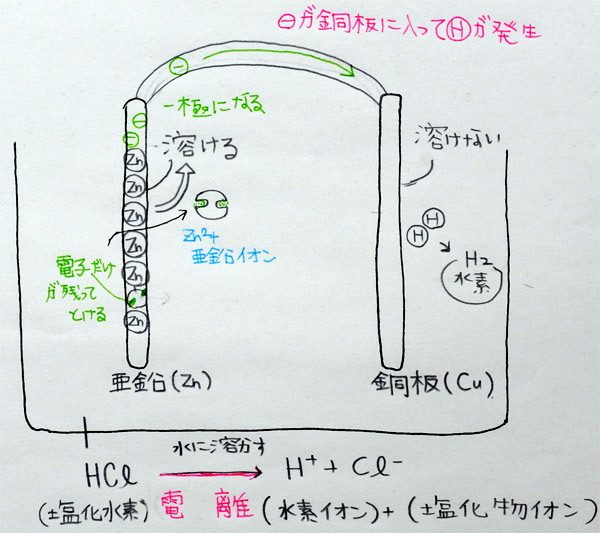
上:Aさんの学習プリント
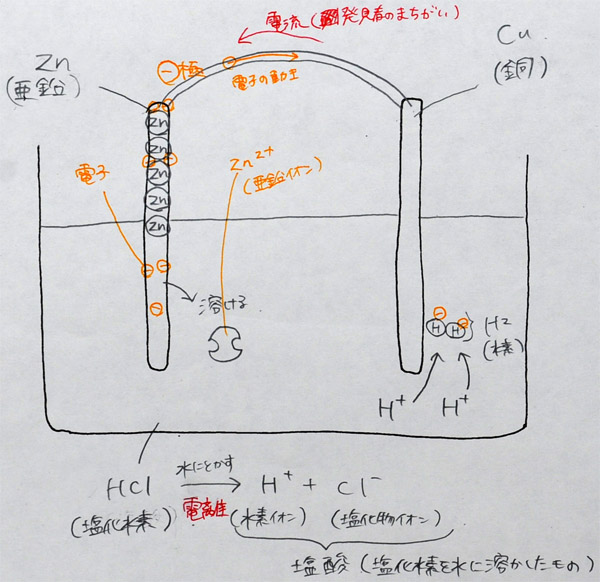

上:Bさんの学習プリント
 |
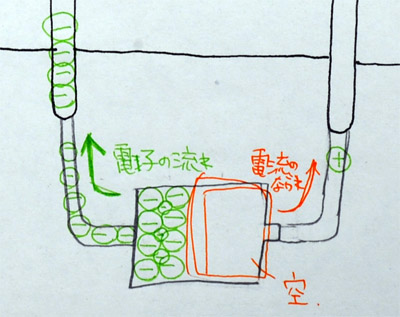 |

上:あるクラスのの板書
授業を終えて
この1時間は、クラスによって内容が若干違います。私の授業は生徒主体に進められるので、リーダーやムードメーカーの言動によって変化するからです。そんな楽しみがあるからこそ、私も楽しく教えることができるし、生徒も楽しく学べるのではないかと思います。