15 電離式の小テスト
2011年10月下旬、普通教室
2学期中間テストに合わせて、電離式の小テストを行いました。私は小テストが嫌いなのですが、今年度一緒に3年生を受け持っている先生が作られた小テストを流用させて頂きました。これをテスト範囲とすれば、生徒も勉強がしやすいでしょうし、テスト作成者も助かります。
本時の目標
(1) 定期テストに出題される電離式を理解し、記憶する
授業の流れ
| 1 本時の目標を知る(3分) 2 電離式について理解を深める(32分) 3 各自で小テストを行う(5分) 4 間違えた式を5回ずつ書き、提出する(10分) |
taka先生のお話
1 本時の目標を知る(1分)
「今日は小テストを行います。・・・クラスによっては、聞いていない! と叫ぶ生徒によって騒然とすることもあるが、無視して・・・この小テストは、来週からはじまる中間テストの範囲になるので、すべて覚えください。ここから数問出題しますので、点取り問題になります。では、問題を配ります。・・・問題を配りながら・・・問題を見れば分かるように、電離式10個が問題です。かなり難しく感じる人もいると思いますが、大丈夫です。初めに約30分ほど使って、詳しく解説します。新しく学ぶこともありますが、ゆっくり復習するので、その間に覚えてください。そして、すべて解説が終って、疑問が解けたところで各自で小テストを行います。小テストはいつものように自分で採点し、間違えたものを5回書いてもらいます。目標は、定期テストで答えられるようにすることなのです。小テストは回収しますが、真面目に書いてあれば得点は関係ありません。」

上:Aさんの学習プリント
2 電離式について理解を深める(32分)
(1) 電離式とは何か!
「まず、電離式とは何か説明できる人? ・・・はい、その通りですね。ある物質が電離したときの式です。プリントにもまとめておきましょう。・・・板書しながら、『電離式とは、ある物質、すなわち電解質を水に溶かしたとき、2つのイオンに分かれることを表した式です。イオンは、+と−の2種類がありますね。
(2) 酸の電離式
「次に、酸の電離式を3つまとめます。まず、酸の代表と言えば・・・塩酸ですね。塩酸の化学式を知っている人? ・・・その通り、HClです。これを水に溶かすと電離して、何と何になるかな? みんな、自分のプリントに書いてごらん。書くときは、矢印を長くして、その上に『水に溶かす』、その下に『電離』と書いてください。・・・期間巡視して、書けた生徒を指名する。できれば、普段目立たない生徒を指名し、板書させる。・・・正解を書いたことを確認して、・・・では、みなさん確認してください。正解だった人? ・・・オッケーです。ポイントは、水素イオンができることですね。酸は、必ず水素イオンができます。」
「第2問、硫酸です。硫酸の化学式を知っている人? ・・・はい、その通り、H2SO4です。これは、覚えるしかありません。難しいとか簡単とかではなくて、全員丸暗記です。できる人もできない人も暗記してください。しかし、電離式は考えれば、分かる人もいます。まず、塩酸と同じように長い矢印を書いて・・・生徒が書いたことを確認してから・・・矢印の上と下に同じように書いて、で、硫酸は酸だから、アレイオンができるでしょ! そして、残ったものがもう1つのイオンだから? ・・・では、自分のプリントに答えを書いてごらん。期間巡視して、書けた生徒を指名する。・・・では、確認しましょう。正解だった人? ・・・オッケーです。ポイントは、水素イオンができることと、残りものとして硫酸イオンができることです。硫酸イオンは、前の時間にまとめましたね。・・・えっ、1日で忘れたしまった人もいるようですが、これは丸暗記です。わからないじゃなくて、暗記するだけです。考えても良いところは、水素イオンが2つできるところです。硫酸はH2SO4なので、Hが2個、すなわち、水素イオンが2個あります。だから、2H+と書きます。また、硫酸イオンはSO4-で1個なので、1は省略して、そのままです。なぜ、SO4が2-になるのか、は昨日説明しました。さっぱり忘れた人は、残念ながら丸暗記してください。」
「第3問、酢酸さくさんです。酢酸は、台所にある酢、食酢に含まれるものですが、とても複雑な化学式です。入試には出ないので暗記する必要はありあせんが、@先生の小テストには印刷されてしまっているので、仕方ないのでやっておきましょう。もしかして、酢酸の化学式を知っている人? ・・・誰もいないようなので紹介します。CH3COOHです。で、同じように長い矢印を書いて、・・・さて、酢酸も2つのイオンになるのですが、この化学式のどこで分かれると思いますか? みなさんに聞いてみましょう。・・・え、C?? それは違うでしょう。酸だから、必ず、あれイオンができます。何イオンができるのかな? ・・・そうですね。水素イオンです。ということで、実は、酢酸は1番最後のHがとれて、H+、水素イオンになります。こんな変な別れ方をするのは酢酸ぐらいで、だから入試にも出ることもないんだけれど、一応書いておきますか。みんなも書いて!」

(3) アルカリの電離式
「次はアルカリの電離式です。まず、水酸化ナトリウム・・・後略・・・」
「2問目は水酸化バリウムです。化学式を答えられる人? ・・・その通り、Ba(OH)2です。ポイントは()です。もし、BaOH2にすると、Hは2個だけど、Oは1個になります。アルカリはOH-、水酸化物イオンがポイントだから、この場合、水酸化物イオンを2個にするために、OHに()をつけてから、その後ろに小さく2を書きます。とうことで、Ba(OH)2になります。ちなみに、バリウムイオンは2+になります。これは昨日学習した通りです。・・後略・・・」
「第3問目のアルカリは、水酸化カルシウム。これは水酸化バリウムと同じだから簡単だよ。・・・後略・・・」
「アルカリは、もう1つあります。それはアンモニア水です。入試にもよく出題されるので、是非覚えてください。まず、アンモニアの化学式を覚えなければ話になりません。知っている人? ・・・正解! NH3です。わからなかった人。暗記してください。さてさて、アンモニアの化学式を良く見ると、NとHしかありませんね。ということは、アルカリを示すOHがない! という困ったことになります。それを解決するために・・・生徒から正解者が出てくる可能性を待つようにして、クラス全体を見渡しながら・・・誰か、この謎を解ける人はいますか? ・・・残念ながらいないようなので、紹介しますと、アンモニアと水が反応して、アレとアレになります。では、一緒に書いてみましょうか。・・・と言って、(アンモニア)+(水)→(?)(?)を板書して、・・・では、この電離式を完成させてください。期間巡視して、書けた生徒を指名する。・・・では、確認しましょう。・・・後略・・・」

(4) その他の電離式
「最後に、酸とアルカリとは関係ない3つの電離式をさらさらっと書いてから、小テストをしましょう。・・・後略・・・」この時点で、90%以上の生徒が本当にさらさらと電離式をかけるようになりますが、明日まで覚えている保証はありません。家庭での復習をどれだけするかがポイントです。
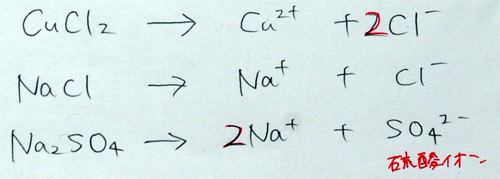
3 各自で小テストを行う(5分)
半数以上が8点以上。酢酸の電離式まで正解した10点満点の生徒は、6人〜8人/クラス(15%〜20%)。
4 間違えた式を5回ずつ書き、提出する(10分)
各クラス5人ぐらいは時間切れで、授業後に提出しました。
授業を終えて
私は実験ばかりに目がいくから、小テストが好きな先生と一緒に授業をするのは良いことだと思います。
|
中学で覚えるイオン、酸とアルカリ |
2学期中間テスト返却 |