実験14 いろいろな中和・塩
2001年6月上旬
今日は中和反応式をまとめるだけではなく、時間が許す限り、いろいろな中和反応によって生じる塩を調べます。中和実験は今日で3回めなので、手際よく進むと思います。たくさんの発見があるのことを期待しています。
(上:紙に試料の名前を書いて順に調べていく生徒達)
このページは、Mr.Taka 中学校理科の授業記録:化学 3年(2001年度)です |
実験14 いろいろな中和・塩
2001年6月上旬今日は中和反応式をまとめるだけではなく、時間が許す限り、いろいろな中和反応によって生じる塩を調べます。中和実験は今日で3回めなので、手際よく進むと思います。たくさんの発見があるのことを期待しています。
(上:紙に試料の名前を書いて順に調べていく生徒達)
<授業の流れ>
1 導 入
<説明の例>
「今日は前半15分がまとめ、後半35分が実験ですが、各班で自由に酸とアルカリを組み合わせて中和実験をして下さい。ポイントは、中和した後にできる塩えんです。まず、酸とアルカリを組み合わせるための表を書き、生成する塩えんの一覧表を作りましょう。これができたら実験ですので、張り切ってまとめて下さい。」2 いろいろな塩をまとめる
<説明の例>
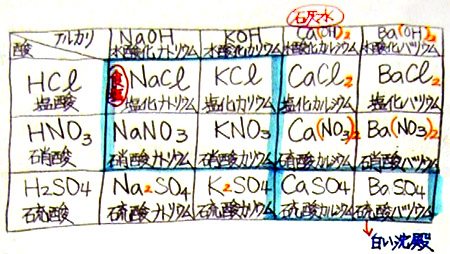
「縦4列、横5列にしますが、もっと書きたい人は増やしても構いません。つまり、先生は酸の例として3つ、アルカリの例として4つしか書きませんが、その他にもたくさんの酸やアルカリがあるので、いくらでも追加して良いということです。さあ、とりあえず、黒板のように表を書いて下さい。」
酸\アルカリ 水酸化Na 水酸化K 水酸化Ca 水酸化Ba 塩 酸 . . . . 硝 酸 . . . . 硫 酸 . . . .
「では、どのように考えるか説明します。まず、塩酸と水酸化ナトリウムの場合は、これは、分かりますね。2時間前に実験しました。中和した液を1滴スライドガラスの上に載せ、水を蒸発させて残った白い粉です。その結晶を顕微鏡で観察しました。A君、何でしたか?・・・そうですね。食塩です。正式名称は?・・・そうです。塩化ナトリウム。つまり、塩酸の塩素と水酸化ナトリウムのナトリウムが結合したものですね。」
「次に、前回の実験、硫酸と水酸化バリウムについて考えてみましょう。以下省略」
酸\アルカリ 水酸化Na 水酸化K 水酸化Ca 水酸化Ba 塩 酸
HCl塩化ナトリウム
NaCl
(食塩). . . 硝 酸 . . . . 硫 酸 . . . .
「それでは、分かった人から書き始めて下さい。分からない人は個別に教えますので手を上げて下さい。もちろん友達どうし教えあっても構いません。また、全部書けた人は手を上げて下さい。書けた人から黒板に発表して欲しいと思います。尚、とっても難しい塩もありますので、頑張って下さい。それでは、始め!」
Bさんの学習プリント
・ 水酸化カルシウム水溶液を「石灰水」という
・
3 生徒実験
班毎に手分けして、手際よく操作していました。次に、下の写真で気づいたことを記します。
・ 左上の生徒は水酸化バリウム水溶液、あるいは、その他の水溶液や沈澱物をろ過しています
・ 右下の生徒は黄の酸性水溶液に、青のアルカリ性水溶液を加えています
・ どれがどの水溶液か、分かるのかしら?
・ 大人には分からない役割や世界があるのでしょう。
(写真左:中和液を加熱して、水分を飛ばし塩を取り出す)
(写真上:学習プリンとに添付された塩)◎ Aさんの学習プリント
・
<授業を終えて>
酸とアルカリはどのような組み合わせでも塩えんが生じることは理解できたと思います。中和の操作も上手くなり、水溶液の濃度についても感覚的に理解できるようになってきました。次時は、硫酸と水酸化バリウムを使って、水溶液に含まれるイオン数を考えます。余談ですが、使ったことがない硝酸に人気が集まりました。
← 前 時
実験13 硫酸・水酸化バリウムの中和反応次 時 →
実験15 中和する時の量