����15�@���a����Ƃ��̗�
�@�@�@�@�@�@�@�@�@�@�@�@�@�@�@2001�@6�@11�i���j
�����́A������Ɠ���ł�
������ĉ�����
���{���̂˂炢��
�@���_�Ɛ��_���o���E�����g���āA���a����Ƃ��ɕK�v�ȃC�I���̗ʂɂ��čl����B

�i��F���_���o���E���̗ʂ����ɂ��āA���_�������Ă����܂��j
��ԍ�����A�Tml�{�Pml���@�A���J����
�@�@�@�@�@�@�Tml�{�Qml���@�A���J����
�@�@�@�@�@�@�Tml�{�Rml���@�_�@��
�@�@�@�@�@�@�Tml�{�Sml���@�_�@��
�@�@�@�@�@�@�Tml�{�Tml���@�_�@��
�@�@�@�@�@�@�Tml�{�Uml���@�_�@��
�@�@�@�@�@�@���@�a�s�a�t�ɂ���Ē��F���܂�
�@�@�@�@�@�@���@�����Œ��ڂ������͔̂��F�̒��a���̗�
�����Ƃ̗��ꁄ
�P�@���@��
�͂��߂Ɏ��̂Q�₵�܂����B�݂Ȃ�����l���ĉ�����
��P�@�Z�����n�t�Ƃ́H
����Ȑ��k�̓�����
�E�@���@��
�E�@�Z�x������
�E�@�O�a�ɋ߂�
�E�@���x������
�E�@�����i�n���A�C�I���j����������n������
�E�@�������Ȃ�
��Q�@���a����Ƃ́H
����Ȑ��k�̓�����
�E�@�^��
�E�@���킹�邱��
�E�@�_���ƃA���J�����̐^�ɂ��邱��
�E�@���f�C�I���Ɛ��_�����C�I���Ƃ̐����ɂ��邱��
�@�@
���͂����̂Q�̖����l�������邱�ƂŁA�w���a�������ʂł͂Ȃ��A���n�t�Ɋ܂܂��C�I���̐��ł����x���Ƃ��C�t�����悤�Ƃ����̂ł����A���k�ɂ͓�����Ď��s���܂����B�e�Ɋp�A�������n�߂������ǂ������ł��B
�Q�@���a�������̊m�F
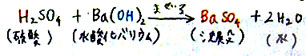
�@�i��F�������������Ă��鉻�w�������Ȃ̂Ŗ�肠��܂���B�j
�R�@���k����
�P�j�@���_���o���E������߂���
�Q�j�@�T�������U�{�̎����ǂɑ���Ƃ�i���}�j

�����ӓ_��
�E�@��s�y�b�g�̎g�������m�F����
�@�u�����̃V���[�v�Ő^�����Ă����v
�@�u�S�̂��ނ悤�ɂ��Ď����A�e�w�ő��삵�܂��v
�E�@�s�y�b�g�͂T�����ƂQ�������g��������
�@�u�T�����̏ꍇ�A�P��ł��傤�ǂT�����Ƃ��悤�ɂȂ��Ă��܂��v
�R�j�@���_��������

�i��F�����珇�ɂP�A�Q�A�R�A�S�A�T�A�U�����������܂��B�j
�����ӓ_��
�E�@���_�̔Z�x�́A�����O�ɒ��߂��Ă����܂��B
�E�@���_���o���E���T�����ɑ��āA�R�D�T�����Œ��a����悤�ɂ��܂�
�E�@�ǂ������Ă���T���ԕ��u������i��}�͍�����O�j
�S�j�@�Еt��
�@���a���ώ@�ł���悤�ɂȂ�܂łT���ȏ�K�v�Ȃ̂ŁA�����Ŏ������u��Еt�������܂��B
�T�j�@���a�ʂ̑���
�@�u�ł́A�����Ŏ��₵�܂��B�v
�@�u�����������Ď��������ꍇ�A���b�ʂ͂ǂ��Ȃ�܂����B�v
�@�����k�̌��ʁ�
�@�@�E�@�F�̂Ƃ����́A�����Ă���
�@�@�E�@���F�̕����́A�ς��Ȃ��i�W�ǁj�����Ă����i�Q�ǁj

�i��F�����ǂ̒�ɂ��܂��Ă��锒�����b�ɒ��ڂ��ĉ������B�j
�E�@���m�Ɏ��������Ƃ���́A���b�ʂ��݂��Ƃɂ�����Ă���
�E�@�������A��̔ǂɂ͂��������܂�
�E�@���̗��R�́A���߂ɑ���Ƃ������_���o���E���̗ʂɂ��������������ł��B
�E�@������Q�{�ڂ̎����ǂ́A���b����̂Ɏ��Ԃ��������Ă��܂��B
�@���@���k�̃m�[�g

�Ō�ɁA���̔�������Ď��Ƃ��I����
��R�@���a�_���߂���Ɣ������a�i�a���r�n�S�j�������Ȃ��Ȃ闝�R�́H
�i�����j
�@�a���i�n�g�j�Q�̗ʂɌ��肪���邩��
�@���@���_���o���E���̗ʂ��A�������鉖�̗ʂ����߂Ă���
�@���@����v��
���@�`����̊��z
