| このページは中学校2年理科『化学』/takaの授業記録2003です |
実験6 使い捨てカイロ(おだやかな酸化)
2004 2 2(月)
第1理科室
|
化学反応式を使ってこれまでの実験をまとめるべきか、それとも、今日の実験で遊ぶべきか迷った。
準備室で『カイロを作る』予備実験をすると、70度Cまで温度上がるので、そこそこに面白い結果が得られるが、問題点は『炭素』で理科中が汚れること。非常に細かい粒子なので、私の年老いた皮膚の奥深くまで侵入したものは簡単に取れない。水道水で洗う= 墨汁で洗う、という公式に気づくのに時間はかからなかった。
さて、結論としては、もう1時間簡単で身近かな実験をする= 化学反応式に親近感が沸く、に期待して本時の実験に踏み切ったが、理科室が炭まるけになったことも予想通りであった。
(右:市販のカイロを分解してかき混ぜると温度が上昇する。どうしてかな?)
|
 |
<班で準備するもの>
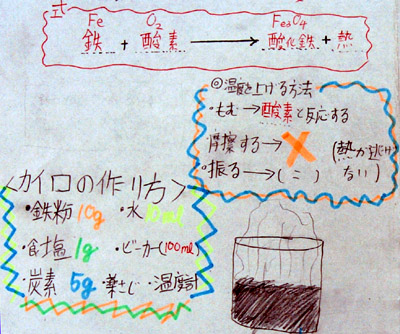
・ 鉄粉10g
・ 食塩1g(触媒)
・ 炭素6g(触媒?)
・ 薬さじ
・ 100mlビーカー
・ 100度C温度計
|
<自宅から持参するもの>
・ 使い捨てカイロ
|
<授業の流れ>
1 導入から実験手順まで
「今日はカイロの実験をします。家から持ってきた人は分解して、何度まで温度が上昇する
か限界に挑戦しましょう。持ってこなかった人は、理科室の材料で手作りカイロを作ります。
さて、カイロを持っている人は裏を見て下さい。成分が表示されていると思いますが、その
うち、温度を上げる成分はどれですか? 細かい成分はメーカーによって違いますが、1番
大切な温度を上げるための成分は同じです。分かった人?」
「はい、そうですね。鉄粉、鉄です。では、これを化学反応式で表わしてみましょう。鉄、
プラス、何とか、やじるし、何とか、タス、熱。じゃあ、点線部分に適当な語句を入れて下
さい。分かった人は黒板に発表に来て下さい。」

「大正解です。前の実験では『スチールウール』を加熱して激しい酸化をしましたが、今日
は『鉄粉』を使っておだやかな酸化を行います。では、化学反応式も復習しましょう。スチ
ールウールと同じです。自分のプリントに書けた人は、黒板に発表して下さい。」
※注意:正しい化学反応式は以下の通り
Fe+ 3/4O2+ 3/2H2O→ Fe(OH)3 + 熱エネルギー
「はいはい、これまた大正解です。なぜ、FeやFeOの前に2がつくのかについては、次
の時間、教室でじっくり説明しますので、今日は我慢して丸暗記して下さい。」
「次に、カイロの温度を上げる方法を考えます。」
(略)
2 生徒実験
生徒実験は次の2つ。
1) 市販カイロの限界に挑戦!
2) カイロを作ろう!
|
1)の実験『市販カイロの限界に挑戦!』は、市販カイロの中身をビーカーに出してかき混ぜるだけ。1分毎の温度を測定して、限界に達したらいろいろなものを混ぜて温度を上げる工夫をする。
ちょっと意外なのが『水』。カイロの中には水分が含まれていて、反応が始まると湯気が出てくる。温度は70度Cまではさっさと上がるが、それ以降は止まってしまうものが多い。そこで、水道水を追加したり、以下の試料を追加したり、各自で工夫をして反応熱を発生させる。
|
 |
2)の実験『カイロを作ろう!』は、とにかく『炭素』をこぼさないように注意したい。雑巾で拭くことも危険である。薬包紙は使わず、ビーカーに直接入れる。これだけは、教師が配付した方が無難である。
<実験のポイント>
・ 鉄粉や炭素、食塩の量は適当でよい
・ 水の量がポイント(どろどろにならない程度)
・ 鉄粉(写真下)は多い方が高温になる
 |

(上:生徒に取りに来させたあとの『炭素』周辺) |
| 準 備 |
作り方 |
・ 鉄粉10g
・ 水30ml
・ 食塩1g(触媒)
・ 炭素6g(触媒?)
・ 100mlビーカー
・ 薬さじ
・ 温度計 |
1 100mlビーカーを用意する
2 炭素を入れる(6〜10g)
3 水を入れて混ぜる(20〜30ml)
4 鉄粉を入れて混ぜる(10〜20g)
5 1分毎に温度を測定する
注 意: 粒子細かい炭素粉末は、後始末が大変です
その他: 結構いい加減な実験で、ほどほどの結果が得られます |

(上:温度計を折らないようにね。) |
 |
|
3 実験結果


◎ A君の学習プリント

◎ Bさんのの学習プリント
<評価基準>
1 自然事象への関心・意欲・態度
A 自宅からカイロを持参できる
B 学習プリントを正確かつ丁寧にまとめられる
2 科学的な思考
B 鉄を酸素が化合するときに熱が発生すること感覚的に思考できる
3 実験・観察の技能・表現
B 1分毎にカイロの温度変化を測定できる
4 自然事象についての知識・理解
B 鉄が酸化する時には熱が発生することを理解できる
授業を終えて
2つの実験を同時に行った班もあったが、とにかく、理科室は炭に塗れた。
次時は、これまでの化学反応式を教室でまとめようと思う。
それから、使い捨てカイロの化学反応式は、
2Fe+ O2→ 2FeO+ 熱エネルギー ではなく、
Fe+ 3/4O2+ 3/2H2O→ Fe(OH)3 + 熱エネルギー です。
各学校の実態に合わせて、御指導下さい。
化学反応式は自由研究とする、のも一案です。
↑ TOP
[→home](C)
2004 Fukuchi Takahiro