8 塩化鉄の電気分解
2011年10月中旬、第2理科室
この実験は、2学期中間テスト前に他クラスより2時間進んでいるクラスで行いました。きちんと材料が準備できれば、明解な結果がでる実験です。しかし、材料となる塩化鉄(2+)の準備が大変なだけでなく、鉄原子や鉄イオンは難しく、現行の教科書(6社)はどこも扱っていません。来年度から施行される教科書では、数社が結果だけを掲載しています。
もちろん、私が塩化銅(2+)を準備すれば簡単ですが、そんな準備をするなら、実験の意味がないので、潮解した塩化鉄(鉄3+)を(鉄2+)にするところから実験をさせまました。できるかな?
 |
. |  |
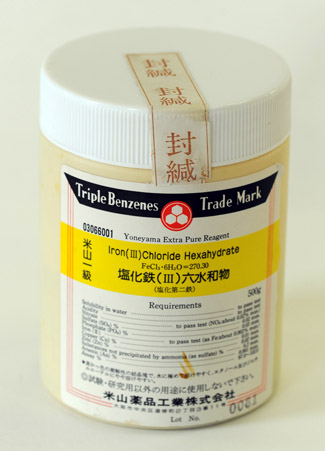
上左:理科準備室の戸棚にあった塩化鉄(FeCl3)。『厳封』は切られていた。
上右:おそるそる蓋を開けると、潮解した赤錆色の塩化鉄が見えた。これを配付する時、生徒から『シャーペットみたい』の声。食べられないんだけれどね。
授業の流れ
1 塩化鉄の電気分解をすることを知らせる(2分)
2 実験結果を紹介する(5分)
3 実権手順を解説する(8分)
4 生徒実験(30分)
5 片づけ(5分)
taka先生のお話
1 塩化鉄の紹介
「みなさんのクラスだけ、2時間も進んでいるので、特別な実験を行います。私も初めて行う実験ですが、塩化鉄の電気分解です。(薬品が入っている容器を見せながら)これは理科準備室にあった薬品、塩化鉄ですが、長年誰も手をつけていなかったようです。容器の蓋には、『厳封』という紙が貼ってありますが、これは空気中の水分を吸収してどろどろに溶けてしまう性質がある物質が入っている場合によく見られます。で、開けてみると(開けて見せながら)ほら、半分溶けたようにして固まった、赤茶色にさびた塩化鉄が見えます。今日は、これを水にとかして電気分解します。」
2 銅イオンはマイナス極へ移動する
「ちょっと水に溶かしてみましょう。(薬さじで5g程度とり、50mlのビーカーに入れ、それに対して50mlのビーカーで水を注ぎながら)こんな風に、赤茶色の水溶液ができます。これでも、電気分解ができそうな気がしますが、実はうまくいきません。教科書には書いてありませんが、ここにある鉄イオンはプラス3だからです。ま、見た通りの赤錆になってしまって、綺麗な鉄ではない、と考えても良いでしょう。そこで、綺麗な鉄のイオン、詳しくはプラス2の鉄イオンにしてから、電気分解します。すると、ピカピカの鉄が出てくるので、ちょっと面白いことになります。さびていない鉄は銀色に輝いているので、吃驚すると思います。先生も初めてみたとき、びっくりしました。また、きれいな鉄イオンは、美しい透明な黄緑色で、これも素敵な色です。是非楽しんでください。では、ここまでをノートにまとめておきましょう。」(黒板に以下の化学反応式を書く)
|
塩化鉄 (電気分解)→ 鉄 + 塩 素 |
とまあ、こんな感じで、これまでに学習した塩化銅の電気分解とまったく同じです。銅が鉄になっただけなので、簡単に理解できるでしょう。塩化銅と同じように塩素ガスが発生するので、脱色反応を試したい人はどうぞ! もちろん有毒です。直接嗅いではいけません。また、炭素棒のかわりにシャープの芯を使ってもよろしい。テイクアウトできます。ただし、実験に使ったあとの薬品は危険なので回収します。手についてもすぐには問題ありせんが、十分な水で洗ってください。
taka先生の予備実験の様子
生徒実験の様子
この日は忙しくて、写真を撮る時間がありませんでした。ちょっとしたスナップ程度です。

上:ろ過中の様子。ろ過の方法はとくに説明しなかったけれど、ちゃんとできていたので感心です! それから、ろ液の色が私の予備実験と違うのは、生徒の各班に配付した塩化鉄(3+)の量が目分量だからです。失礼しています。濃塩酸は、ピペットで正確に配付しました。

上:炭素棒を使って電気分解する様子。ただし、よく見ると、左の炭素棒(黒)から塩素ガス、右の炭素棒(赤)に鉄が析出しているので、リード色が逆になっている。本来は、−極(黒)は鉄、+極(赤)は塩素。まあ、この班の生徒は逆になっていても、ちゃんと理解できる優秀な生徒達が集まっているから大丈夫だけど。

上:+極に析出した鉄を見せてくれた生徒。
授業を終えて
私自身も初めての実験でしたが、ほぼ予備実験の通りの結果が得られました。濃塩酸を入れたり、鉄を溶かしたり、ろ過したり、銀色に光る鉄が出てきたり、プール臭い塩素が出てきたり、生徒達も高級感ある実験を喜んでいました。
時間に余裕があれば、是非試してみたい実験です。
おまけ
予備実験に疲れて、流しにビーカーを置き、その中に薬さじを放置したままにしてしまったのですが、翌日見ると、薬さじに鉄が析出しているではありませんか!(写真下) 鉄イオン(3+)は析出しませんが、同じ鉄イオンでも(2+)になると析出するのです。やっぱり鉄は難しいというか、面白いと思った瞬間でした。銅版画のエッチングに使う水溶液でもあります。

上:もともと汚れた薬さじを使っているので、黒かったり茶色かったりしています。中学の実験室はこんなものです。悪しからず。
|
塩酸の電気分解 |
いろいろな電解質の電気分解 |







