第63時
実験9 食塩と食塩水の電気分解
2018 11 1(木)、2(金)
普通教室
はじめに
実験方法は、前時『塩酸の電気分解』とほぼ同じです。H管に入れる水溶液を食塩水に変えるだけです。
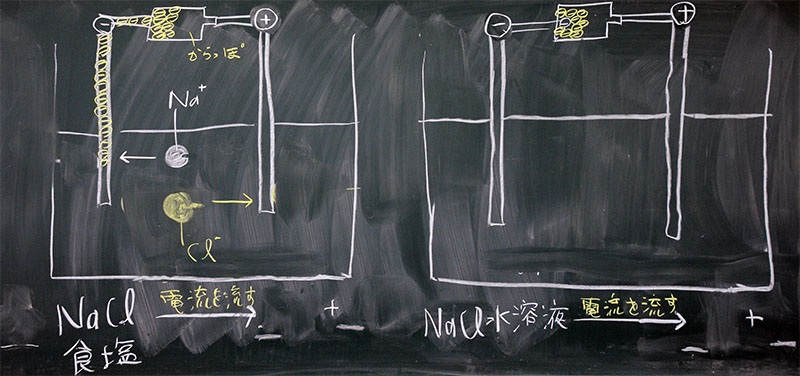
今日のポイントは、食塩と食塩水の違いです。食塩は塩化ナトリウムという化合物、食塩水は水素イオンと塩化物イオンを含む水溶液です。それらに電流を流す場合、当然、違いがあります。
固体の食塩は電流を流しませんが、高温に加熱して液体にすれば、電流を流します。−極にナトリウム、+極に塩素が発生するはずです。中学の理科室で行える実験ではないので、化学反応式とそのモデル図でまとめます。一方、食塩水は、−極に水素、+極に塩素が発生させます。−極に引き寄せられるイオンは『Na+』と『H+』の2つがありますが、イオン化傾向が小さい『H+』がイオンでなくなります。イオン化傾向の大きい『Na+』は、そのまま水溶液中に残ります。
図1:実験中のスナップ