第64時
実験10 イオン化傾向
アルミニウムと銅の置換反応
2018 11 5(月)、6(火)
普通教室
はじめに
イオン化傾向の定義は簡単ではありません。化学を専門としない私は、授業で扱うために勉強しましたが、数時間では十分に理解できませんでした。中学生に教える内容やレベルは時代によって変わりますが、最近の私は次のように教えています。
中学レベルのイオン化傾向
(1)金属原子は、電子を放出して+イオンになる
(2)その傾向(イオンへのなりやすさ)をイオン化傾向という
(3)イオン化傾向に順に並べると、次のようになる
Na > Mg > Al > Zn > (H2) > Cu > Au
(4)MgとCuを塩酸に入れると、Mgの方がよく溶ける(Cuは溶けない)
(5)溶ける時、Mgは、電子(−)を残していく
(6)塩酸のH+は、電子をもらって水素分子(H2)になる
(7)これは、H+とMgの置換反応、と考えることもできる
※H2(H)よりイオン化傾向が小さいCuやAuでは、置換反応は起きない
(8)塩化銅水溶液(Cu2+)にAlを入れると、Cuが析出する(置換反応) |
私がこれまでに実践した授業は、2つ手法があります。1つは塩酸への溶けさすさを調べるもの『5つの金属のイオン化傾向3年(2011年度)』、もう1つは置換反応を確かめる本時、です。 いずれも、子どもたちをイオン化傾向の入り口に誘うものであり、化学電池を一歩深く理解させるために使うものです。

図1:アルミニウムがボロボロになり、その表面に銅が析出している
本時の目標
・金属原子はイオンのなりやすさ(イオン化傾向)の順によって並べることができることを知る
・アルミニウムと銅の置換反応実験を行い、アルミニウムの方がイオンになりやすいことを確かめる
|
準 備
| 生 徒 |
教 師 |
|
- 本日の学習プリント(1 /人)
- アルミホイル(5cm2/人)
- 塩化銅(1g / 班)
- 50mLビーカー(1 /班)
- セロハンテープ(1 /班)
|
授業の流れ
(1)本時の授業内容の紹介 (1分)
(2)イオン化傾向の紹介(7分〜10分)
以下の手順で確認・紹介します。
1)元素92種類のうち、金属は70種類
2)金属原子は、+イオンになる
3)イオンへのなりやすさをイオン化傾向という
4)その傾向は、金属によって違う
5)+イオンになるとき、電子を出す(電子を残していく)

図2:イオン化傾向
H2(水素)は金属ではありませんが、入れてあります。その理由は、金属原子が放出した電子によって、水素が発生することがよくあるからです。水素が発生する手順は以下の通りです。
1)金属原子が+イオンになり、電子(-)を放出する
2)水溶液に水素イオン(H+)がある場合、それが電子(-)を受け取る
3)水素原子(H)ができ、連続して水素分子(H2)になる
以上1)〜3)の現象として、金属が溶けて水素ガス(H2)が発生します。
(3)アルミニウムと銅の置換反応:手順と原理(5分)
塩化銅1gに水50mLを加え、塩化銅水溶液を作ります。この水溶液には、銅イオンと塩化物イオンがあります。それに、アルミニウムを入れると、イオン化傾向の違いによって置換反応が起こります。アルミニウムと銅を比べると、アルミニウムの方がイオンになりやすいので、アルミニウムが溶けて銅が析出します。
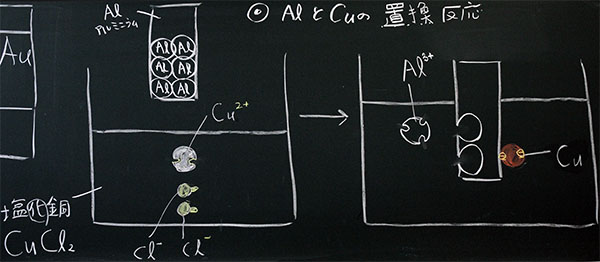
図3:�塩化銅水溶液にアルミニウムを入れた時のモデル図(未完)
(4)アルミニウムと銅の置換反応:生徒実験(10分〜15分)

図3:塩化銅に入れたアルミニウム |
. |

図4:同左 |

図5:アルミニウムを取り出す
塩化銅水溶液の色が薄くなっている点に着目! その理由は、青色の銅イオンが少なくなってきてからです。

図6:アルミニウムはボロボロになり、その表面に銅が析出している
(5)置換反応をモデル図にする (5分〜10分)
アルミニウム原子がイオンになる時に放出する電子は3個です。これに対して、銅イオンが銅原子なる時に受け取る原子は2個です。そのままでは電子の数が合いません。そこで、3と2の最小公倍数6、になるようにします。つまり、アルミニウムの電子=銅の電子=6、にします。
電子6個=アルミニウム原子(電子3個)×2個
電子6個=銅原子(電子2)×3個
アルミニウムと銅の置換は、アルミニウム:銅=2:3、の割合で行われます。
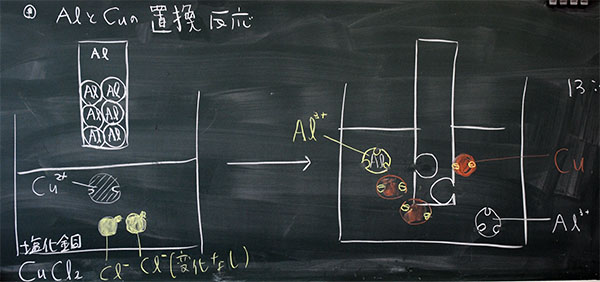
図7:アルミニウムと銅の置換反応のモデル図
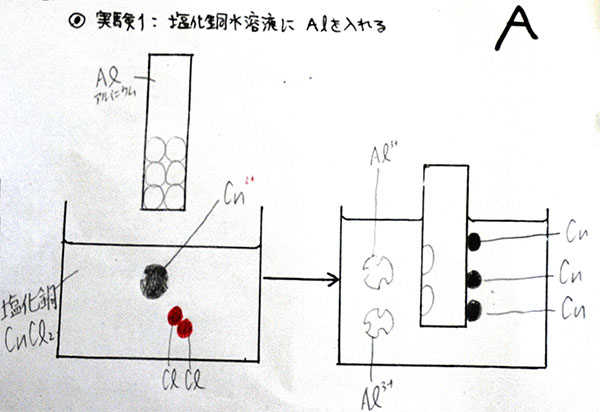
図8:制限時間内に書くことできた生徒は、先生の合格サイン『A』がもらえる

図9:実験後の廃液を回収(かなり薄い色になっている)
(6)本時の感想、考察 (5分)

図10:Aさんの学習プリント
授業を終えて
簡単な実験ですが、アルミニウムと銅の置換という現象で、イオン化傾向について理解できたと思います。また、7年前の実践『5つの金属のイオン化傾向3年(2011年度)』ではいろいろな金属を塩酸に溶かすことでイオン化傾向を調べています。金属の形状や接触面積の違いなどの問題点がありますが、悪くない方法です。お試しください。
時間が許せば、両方とも実践すると良いでしょう。その場合、本時を先に行い、『5つの金属のイオン化傾向3年(2011年度)』を後にすると良いでしょう。後者では、それぞれの電離式、置換反応式(イオン式を含む)など、いろいろな化学反応式の復習ができると思います。
note:生徒と先生の会話
「先生、色がなくりました」
「銅イオンがなくなった、ということですね」
実践ビジュアル教科書『中学理科の化学』
↑ TOP
[→home]
(C) 2018 Fukuchi Takahiro










