第65時
実験11 HClと金属2種類による化学電池
2018 11 6(火)、7(水)
第2理科室
はじめに
化学電池は、塩酸と2種類の金属の金属によって作ることができます。その根本原理は、金属のイオン化傾向の違いです。塩酸の中に金属を入れると、小学校で学習したように金属が溶け、水素(H2、気体)を発生します。化学電池は、よく溶ける金属(イオン化傾向:大)から溶けにくい方向へ電子が移動する現象です。
中学2年生の化学では、塩酸と金属から水素が発生する化学反応式を学びます。物理では、電気の正体は『電子』であることを学びます。3年生になると、化学電池で『電子の受け渡し』を学びます。塩酸に金属が溶けて+イオンになるとき、金属は電子を残していきます。その電子は、塩酸に含まれる+イオンに渡されます。その+イオンは『水素イオン』であり、水素(H2)ガスとして発生します。
ここで生まれる疑問は、なぜ『電子の受け渡しが行われるのか』です。考えるための鍵は『イオン化傾向』であり、金属イオンと水素イオンを比較すればわかります。水素イオンよりも金属イオンの方が大きいので、金属原子がイオンになり、水素イオンが水素になるのです。
===
ところで、2011年度の実践では、イオンの導入として『化学電池(3年化学分野の導入)3年(2011年)』を行いました。正直なところ、化学電池から入った方がイオンに興味を持ちやすいと思います。
参考・関連ページ
化学電池のしくみ3年(2011年)

図1:化学電池のしくみについて発問する taka先生
本時の目標
・化学電池のしくみについて理解する
・塩酸と金属2種類を使って、化学電池をつくる
・金属の組み合わせによって、+極と−極が決まっていることを確かめる
・金属の組み合わせによって、電気の大きさが違うことを調べる
・次時、自宅からいろいろな水溶液を持ってくることを知る
|
準 備
| 生 徒 |
教 師 |
|
- 本日の学習プリント(1 /人)
- 1N塩酸(100mL /班)
- 100mLビーカー
- 金属板フォルダー
- マグネシウムリボン(10cm)
- 銅 板
- 亜鉛版
- アルミニウム板
- 導 線
- 電子オルゴール
|
授業の流れ
(1)本時の授業内容の紹介 (1分)
(2)化学電池の理論 (10分〜15分)
このページ冒頭で紹介した通りです。ポイントはイオン化傾向ですが、これについては前時『イオン化傾向』をご覧ください。
中学レベルのイオン化傾向
(1)金属原子は、電子を放出して+イオンになる
(2)その傾向(イオンへのなりやすさ)をイオン化傾向という
(3)イオン化傾向に順に並べると、次のようになる
Na > Mg > Al > Zn > (H2) > Cu > Au
(4)MgとCuを塩酸に入れると、Mgの方がよく溶ける(Cuは溶けない)
(5)溶ける時、Mgは、電子(−)を残していく
(6)塩酸のH+は、電子をもらって水素分子(H2)になる
(7)これは、H+とMgの置換反応、と考えることもできる
※H2(H)よりイオン化傾向が小さいCuやAuでは、置換反応は起きない
(8)塩化銅水溶液(Cu2+)にAlを入れると、Cuが析出する(置換反応) |
↑
前時(置換反応)
本時(化学電池)
↓ |
(1)同上
(2)同上
(3)同上
(4)同上
(5)同上
(6)MgとCuを使った化学電子では、Mgが−極、Cuが+極になる
(7)化学電池は、MgとCuをつなぐリード線を移動する電子の流れ、である
(8)リード線がなければ、電流は発生しない
(9)化学電池をつくる金属の組み合わせは自由
(10)ただし、同じ金属ではできない
(11)イオン化傾向が大きい金属は電子を残すので、−極になる
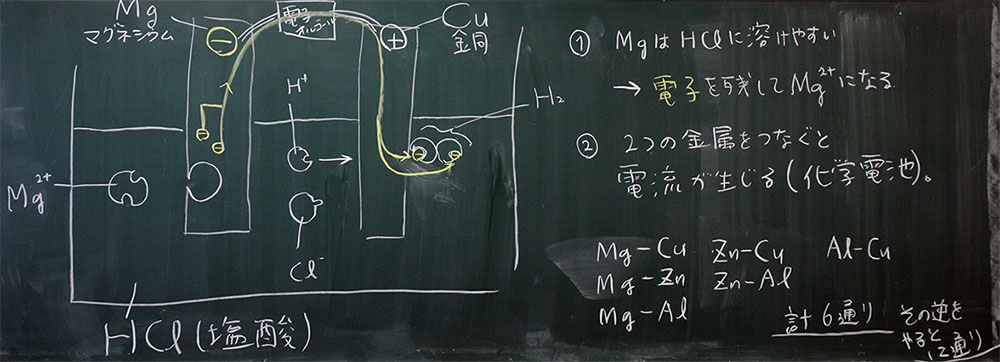
図2:A組での板書(クリックすると拡大します)
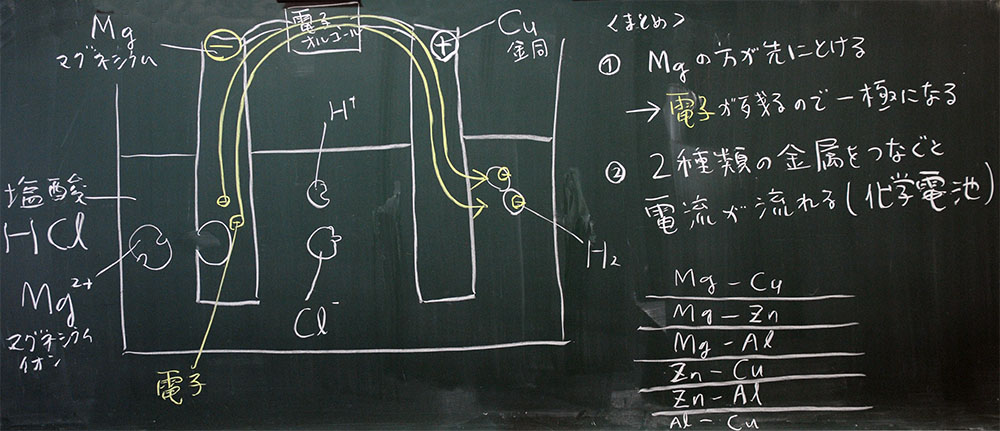
図3:B組での板書(クリックすると拡大します)
|
(3)大きな電流をつくる方法 (3分〜5分)
わかりきったことですが、一応まとめておきます(図4、図5)。

図4:大きな電流をつくる方法

図5:同上
実際の実験では、金属板どうしを接触させる子どもがいます。塩酸の中で金属を接触させると、そこで電子が移動するので、化学電池はできません。化学電池の電流は、金属2種類をつないだとき、その導線を流れる電子をさしているからです。
(4)実験手順の確認 (5分〜7分)

図6:亜鉛板を塩酸に入れ、真っ黒になることを紹介するtaka先生
亜鉛板が真っ黒になるのは、亜鉛原子が塩酸に溶けていくからです(クリックすると真っ黒になった亜鉛板)。溶けるだけなら色は変わらないように思いますが、亜鉛は溶けていく時に表面の大きな凹凸ができます。金属光沢は平らな表面における反射によるものですが、塩酸に溶けた亜鉛は光を反射することなく全て吸収するかのようになるので、真っ黒に見えるのです。
(5)生徒実験 (20分〜30分)

図7:アルミニウムと亜鉛による化学電池

図8:電子オルゴールの鳴り方で、電流の大きさを記録する

図9:黒くなった亜鉛板
片付ける時は、物理的な力を使って表面を平らにします。目の粗いスポンジでも何とかなりますが、できればスチールウールを用意してください。簡単に削り取ることができます。

図10:マグネシウムと亜鉛
塩酸の入ったビーカーには無数の水素の気体が観察できる

図11:銅板とマグネシウム

図12:アルミニウムと銅による化学電池

�図13:耳を近づけ、かすかな音を聞こうとする子ども

図14:学習プリントに記述するA君
(6)本時の感想、考察 (5分)
授業を終えて
発生した電流の大きさを数値化できれば良いのですが、うーん、でした。また、電子オルゴールの感度にばらつきがあり、適切な実験結果が出なかった班もありました。
note:生徒と先生の会話
「先生、亜鉛の汚れがとれませ〜ん」
「汚れではなく亜鉛です。光を吸収するほど表面がぼろぼろになった金属亜鉛です」
関連ページ
参考・関連ページ
化学電池(3年化学分野の導入)3年(2011年)
化学電池のしくみ3年(2011年)
実践ビジュアル教科書『中学理科の化学』
↑ TOP
[→home]
(C) 2018 Fukuchi Takahiro













