このページは、Mr.Taka 中学校理科の授業記録:化学 3年(2001年度)です
|
塩化銅の電気分解のしくみ
2001 5 8(火)、各教室
このページは2005年3月に加筆しました
今日も、実験お休みです。
前回、こでまでの電気分解の総復習をしようとしたのですが、みなさんの定着率が悪いようで・・・私自身も反省!/ 今回も教室です。1時間じっくり塩化銅の電気分解のしくみを考えることにしましょう。
大切なことは、丁寧に色鉛筆でモデルを書くことです。復習が多いのですが、とにかく丁寧に(塩素原子、塩素分子、塩化物イオン)、(銅、銅イオン)、そして、電子を書くことです。全部分からなくても綺麗にまとめておけば、何回も見直しているうちに愛着が湧き、だんだん分かってきます。無理は禁物。1時間で、ほんの少しだけ前進すれば良いのです。慣れることも大切です。それでは、みなさん、ゆっくり学習を始めましょう。
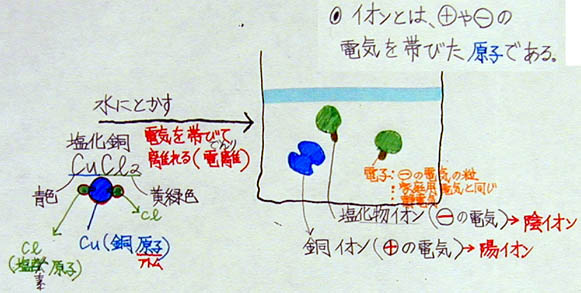
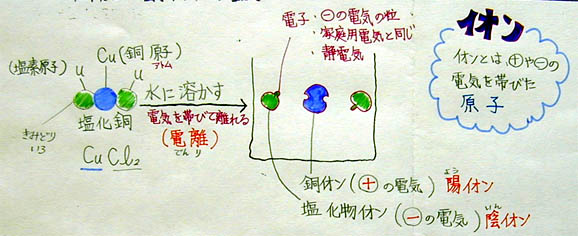
(上:電離についてまとめたA君の学習プリント)
<本時のねらい>
塩化銅を使って、次の5点を理解させる。
1 ある物質が水に溶け、電気を帯びて離れること電離という
2 電離する物質を電解質という
3 プラス、または、マイナスの電気を帯びた原子をイオンという
4 電解質水溶液に電流を流すと、+極に−イオンが、−極に+イオンが集まる
5 このように、電気によって電解質を分解することを電気分解という
(上:学習プリントの真ん中にビーカー、その左側に長い矢印を印刷しておきます)
<授業の流れ>
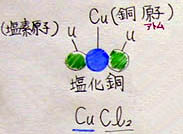 1 塩化銅について
1 塩化銅について
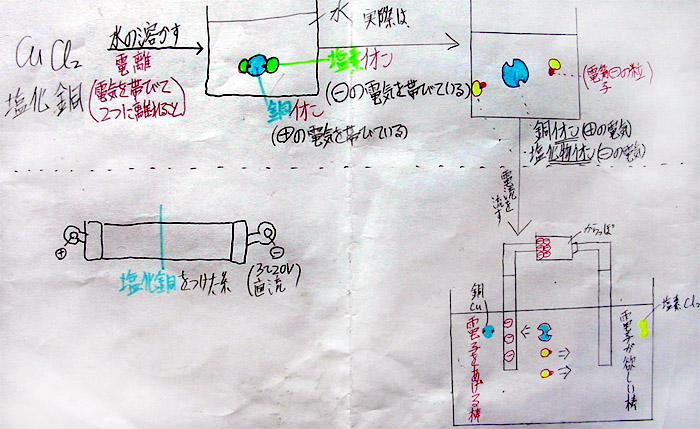
1) 化学式は、CuCl2
→ 塩化銅分子という
→ 分子の説明については2000年度の実践『分子と原子』を参考にして下さい。
2) 銅原子1個と、塩素原子2個が結合したもの
→ 割り合いは1:2であり、1:1や、2:1にならない。割り合いが変われば異なる性質を持った違う分子になる。今日の段階では丸暗記させるが、後日、原子周期表を復習したときに規則性を紹介する。
・ 原子を、アトムという
・ 鉄腕アトムと同じ
・ それらの原子は接するように書かせる(銅原子と塩素原子を互いに食い込ませるのではなく、接するように書かせる。そうすれば、あとから銅原子の中に電子を埋め込ませることができる。)
 <ここまでの説明例> <ここまでの説明例>
「今日は、塩化銅の電気分解をモデルを使って考えます。/ まず、日本語で塩化銅と書きます。ただし、今日の主人公はモデルなので、これから書くモデルのスペースを空けて下さい。スペースの下に塩化銅と書いて下さい。」
「書けたようですね。さあ、塩化銅の化学式を書きましょう。覚えている人?」
「はい、その通りです。CuCl2です。Cl2の2は小さく書くので注意して下さい。さてさて、ココから本番ですが、CuCl2をモデルで書くとこうなりますが、(黒板に書いたものを消し、)もう一度同じものを書きますよ。先生の説明をよく聞いてから、自分のプリントに丁寧に書いて下さい。/ まず、Cu、銅を書きます。次にCl、塩素を書きますが、塩素は2つです。Cl2の2は塩素が2つあることを示しているのですね。それから、白黒の鉛筆で書いていては面白くないので色をつけます。みなさん! 銅は何色でしたか?・・・そうですね。青です。ですから、色鉛筆で青色にぬって下さい。ただし、後から書き込むことがあるので、薄くぬって下さい。次に、塩素は何色にしましょうか?・・・ううん、そうですねえ。2時間後に実験をすると分かるのですが、塩素は水に溶けると薄い黄緑色になるので、黄緑でお願いします。これも濃くぬらないように注意して下さい。先生が黒板に書いてみますよ。まだ書かないで下さい。・・・ほら、こんな感じです。そして、その他に2つ注意して欲しいことがあります。1つは、銅を少し大きく書くことと、もう1つは銅と塩素を重ねず、ぎりぎり引っ付いているように書くことです。それでは、分かった人は自分のプリントに丁寧に書いて下さい。」 |
2 塩化銅を水に溶かす→ 電離
・ ある物質が水に溶けることを溶解という
・ 塩化銅(分子)は、水に溶解すると電気を帯びた原子(イオン)になる。
・ このように、電気を帯びて離れること『電離』という。
・ 銅原子は陽イオン、塩素原子は陰イオンになる。
・ 陰陽については、電子の受け渡しによって説明できる。
→ 後日、原子周期表を復習したときに、各原子の規則性を紹介する。
|
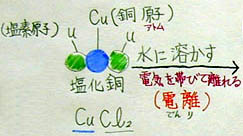 <電離の説明例> <電離の説明例>
「次に、塩化銅を水の溶かします。長い矢印の上に水に溶かす、と書いて下さい。・・・書けたようですね。さて、矢印の下は、溶かすとどんな反応が起こるか書いてもらいますが、塩化銅は単純に溶けるだけではありません。銅原子が塩素原子がばらばらに離れるだけでなく、プラスとマイナスの電気を帯びて離れます。このような現象を何と言うか、誰か予習をしてきた人はいませんか?」
「素晴らしい! 大正解です。ある化合物を水に溶かした時、原子(注意:ここでは原子団まで触れない方が良いでしょう)が電気を帯びて離れることを電離と言います。このように電離する物質を電解質と言います。」
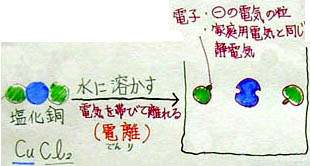 <塩化銅水溶液の説明例> <塩化銅水溶液の説明例>
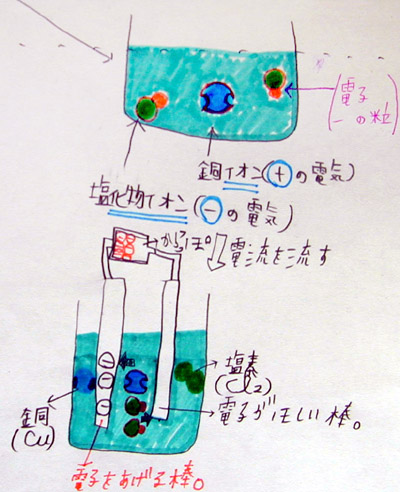
「(黒板にいっぱい書いてあると分かり難いので、必要でないものを消しますね。さあ、すっきしました。)ビーカーの中の銅原子と塩素原子のモデルを書きます。色は先ほどと同じにして下さい。塩化銅の銅原子は1個、塩素原子は2個なので、ビーカーにも同じように書きますが、プラスマイナスを表現するために小さなポッチを使います。塩素原子には小さなポッチを1つ付けて下さい。銅原子には、小さなポッチがとれてしまった穴を2つ書いて下さい。銅原子に穴が2つ空いているのは、銅原子の左右に塩素原子が付いていたからです。この小さなポッチの説明は、皆さんが書いてからしますので、まず、プリントに丁寧に書いて下さい。ただし、ポッチの色は黄色に指定します。」
「みなさん書けたようですね。さて、質問です。この小さな黄色のポッチは、2年生の時の電流の授業で学習したものですが、覚えている人はいますか?・・・あれ、いませんか! ヒントは、マイナスの電気を帯びた粒です。」
「はい、よく分かりましたね。電子です。教室の蛍光灯の中を走っているのも、扇風機のモーターを動かしているのもマイナスの電気を帯びた電子です。そして、今勉強している塩化銅水溶液の中にある小さなポッチも電子です。全く同じものです。不思議な感じがしますが、皆さんの髪の毛を擦っても電気が発生しますが、その電気も、同じ電子によって説明できます。」
|
(上:塩化銅の電離までまとめたB君の学習プリント)
3 塩化銅水溶液の電気分解
これまでの1、2の説明に必要な時間は15〜20分だったと思います。次に、水溶液に電極を差し込み、電流を流したときの電子の受け渡しを説明しますが、これも15〜20分必要になるでしょう。以下に、黒板を使って説明例を紹介します。
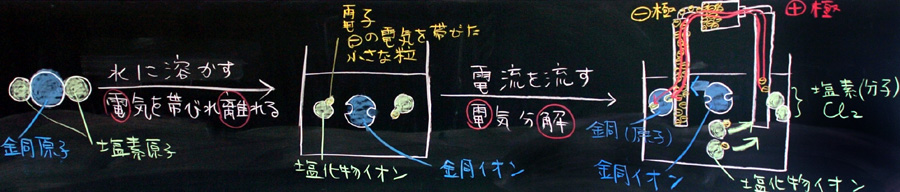
(上:これから説明する板書例。ポイントは、電離と電気分解を続けた横長の図にすることです。)
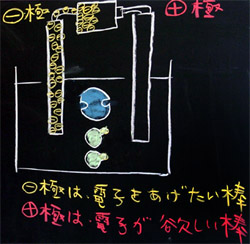 (1) 電極を入れる
(1) 電極を入れる
「それでは塩化銅水溶液に2本の電極を入れましょう。炭素棒です。なお、後から炭素棒の中に電子を書くので、あまり細く書かないようにして下さい。」
(2) 電極に乾電池をつなぐ
「電極を入れただけでは何の変化も起こりませんが、乾電池をつなぐと電気分解が始まります。さて、電気分解の様子を調べる前に、乾電池をつないだ時の炭素棒の変化を調べましょう。/ +極を右にして乾電池してつなぐと・・・こんな感じですね。/ はい! ここで質問です。みなさんは、乾電池の中に電子がいっぱい詰まっていることは知っていると思いますが、電子あるのはプラスマイナスのうち、どちらですか? これは全員に答えてもらいます。プラスだと思う人は手を挙げて下さい。」
「残念! はずれです。電子が帯びている電気は+でしたか? それとも−でしたか?・・・そうですね。電子は−の電気を帯びた小さな粒なので、乾電池の−極にうじゃうじゃ電子がつまっていて、一方、+極は何もありません。空っぽです。ですから、−極は電子をあげたい棒、+極は電子が欲しい棒になります。」
「さあ、みなさんも−極側にだけ、うじゃうじゃ電子を書いて下さい。」
(3) 電極に電流を流す
「ここまで書けば、水溶液中のイオンがどちらに移動するかは簡単ですね。プラスとマイナスが引き合うように移動するだけです。では、C君に答えてもらいましょう。銅イオンは+極−極のうち、どちらに移動しますか?」
「はい、その通りです。陽(+)イオンである銅イオンは−極に移動します。そこで電子を2つもらい、安定した銅になります。正確には電気を持っていない粒に戻ったので、銅原子と言います。」「逆に、塩化物イオンは陰(−)イオンなので+極に移動します。そこで、余分にくっついていた電子をとってもらいます。まるで、昔話の『瘤取り爺さん』のようですね。そして、塩素原子が2つ結びついた塩素分子になります。余談ですが、塩素分子は、酸素や水素と同じように、必ず2つ原子が結びつくことで、始めて塩素としての性質を持ちます。1つでも3つでもいけません。塩素原子は、いつも仲良く2個でいるのが大好きな性格なのですから仕方ありません。塩素の性格を認めてあげましょう。」
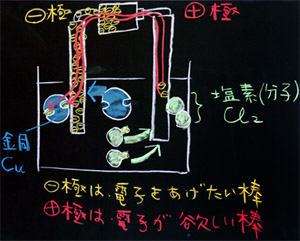 (4) 電子の動き
(4) 電子の動き
「ここで乾電池の働きを確認しましょう。乾電池の+極は電子を奪い取る働き、−極は電子を与える働きをします。ですから、水溶液中の塩化物イオンは、余分についている電子をとってもらう訳ですが、その電子は、こんな風に、ぴゅうううーっと乾電池の−極の方へ移動したかと思うと、そのまま、炭素棒を通って、水溶液中の銅イオンの穴に、ぱこっとハマります。結論として、2個の塩化物イオンについていた電子が、銅イオンの2つの穴にハマって、みんなニコニコ(2個2個)ですね。あれっ、滑ったかな?」
(左:赤い線は電子の動きを表わしています。)
◎ Aさんの学習プリント
◎ Bさんの学習プリント
4 本時のまとめ
前にも示しましたが、水に溶かした時の電離式と電流を流した時の電気分解の式を連続して書くことがポイントです。私の授業では、B4の紙を横にして書きましたが、幅30cm以上のノートか記録用紙が必要でしょう。2つの式を横長に書くことで、電子の受け渡しがはっきりするだけでなく、分子・原子・イオン・電子の違いが明確になってきます。ほとんどの参考書や教科書では、紙面の関係上、連続して説明することができないので、中学校の黒板を使う場合には、是非とも左端から右端までフル活用して下さい。検討を祈ります。

(上:電離式と電気分解の式を連続して書く)
◎ 授業のワンポイントレッスン
一般に、黒板に書いたことは消さない方が良いと言われていますが、説明が煩雑になるのを防止するために、重要でない部分を消すことは非常に有効な手段です。
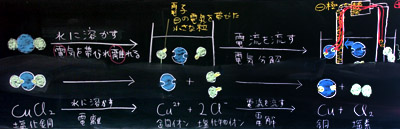
そして、終業のチャイムが鳴る前に、生徒自身で反省(感想、発見、疑問)を書かせる時間を取りますが、その際、黒板に、1時間の授業の要点だけが残っていることは、頭が整頓されます。全て残しておくことは基本ですが、教壇に立って数年経ったなら、是非とも、黒板を消すテクニックを習得して下さい。 |
↑ TOP
[→home]
(C) 2001-2005 Fukuchi Takahiro