| このページは中学校2年理科『化学』/takaの授業記録2003です |
原子周期表、原子と分子
2004 2 12(木)
第1理科室
学年末テストが近づいているので、予定を変更してテスト範囲を終了することにした。
テスト直前にあたる来週の月曜日と火曜日は、『質量保存の法則』とそれを検証する
実験を行う。
1 H
水 素 |
原子番号 原子記号
原子名 |
2 He
ヘリウム |
3 Li
リチウム |
4 Be
ベリリウム |
5 B
ホウ素 |
6 C
炭 素 |
7 N
窒 素 |
8 O
酸 素 |
9 F
フッ素 |
10 Ne
ネオン |
11 Na
ナトリウム |
12 Mg
マグネシウム |
13 Al
アルミニウム |
14 Si
ケイ素 |
15 P
リ ン |
16 S
硫 黄 |
17 Cl
塩 素 |
18 Ar
アルゴン |
19 K
カリウム |
20 Ca
カルシウム |
水色は金属
正しくは元素周期表だけれど、現行の教科書では「元素」という言葉を使わないので、混乱を避けるために原子(アトム)として指導した。なお、元素と原子の違いを知りたい先生は、ココをクリック。
|
47 Ag
銀 |
26 Fe
鉄 |
| . |
29 Cu
銅 |
79 Au
金 |
◎ 授業の流れ
1 テストに出題される問題プリントの配付(5分)
テストの出題される問題プリントを配付し、それに関連する教科書を読んで簡単に説明した。
<学習内容>
・ 銅の質量と化合する酸素の質量は『比例』の関係にある
・ 2Cu+ O2→ 2CuO
・ どちらか一方の物質の量が多くても、反応する相手の物質がなければ反応は進まない
→ 実際に問題を解かなければ理解できないと思うが、それはそれ。テストが終わってから
詳細に説明する必要が出るかも知れない。
2 原子周期表
初めて原子周期表を生徒に紹介したのは前回の定期テスト返却時。あれから1ヶ月弱ぶりに
復習することになるが、生徒はさっぱり忘れていた。それでも、1度学習した経験があるな
しでは学習効果に大きな違いがある。今日は『原子番号1番』からテンポよく同時進行で紹
介した。
「では、原子番号1番から一緒に書きましょう。1番はココ。宇宙で1番小さい、軽い原子
です。何でしたか?」
「はい、そうですね。水素です。記号は?」
「はい、そうです。Hです。」
「原子番号2番はココ。宇宙で2番目に小さい原子で風船の中に入っています。何でしたか?」
「はいそうです。『へ(He)』と書いて、ヘリウム。」
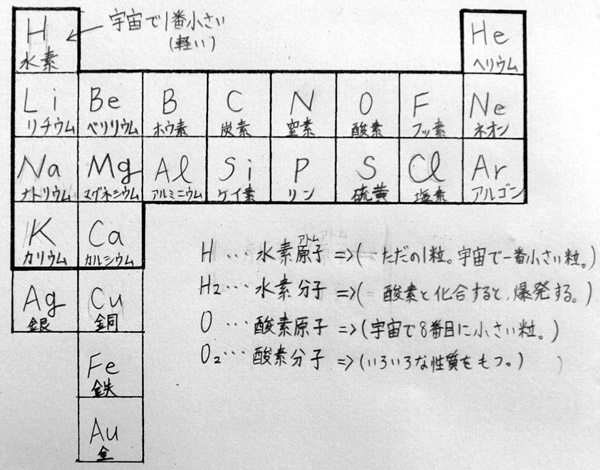
(上:Bさんの学習プリント)
クラスによっては、「先生、水素はH2じゃないの?どうして、どうして!!」
と大きな声で一歩もひかない生徒が出てくるので、そう言う場合は、ここで、原子と分子の
違いを説明する。上のBさんの学習プリントにあるように、HとH2の違いをごく簡単にま
とめる。そして、酸素のところで、同じようにOとO2の違いをまとめる。ここでは深く追
求しない姿勢を育てることが最大のポイントである。
3 原子と分子
原子とは何か。これを突き詰めれば理科好きになることは間違いないが、一般人(生徒)を
対象に熱弁を振るうことは危険である。ガスを止め忘れた風呂釜の内の温度が99度Cから
1度上昇してしまう時のように理科嫌いが暴発するだろう。ここはどれだけ簡単に説明し、
「簡単だあ!」と言わせるのがプロ教師としての腕の見せどころである。頑張って下さい。
「OもO2も酸素ですが、それらの違いは何だと思いますか。テストの時、区別できなくて困ることが多いので、ちょっとまとめておきましょう。正しく言うと、Oは酸素何とかで、O2は酸素何とかです。どちらかが分子で、どちらかかが原子です。」
「お、知っている人がいますね。Oが酸素原子で、O2酸素分子です。原子はただの粒ですが、分子は性質をもった物質になります。例えば、Oは宇宙で8番めに小さい粒に過ぎませんが、その粒が2つ引っ付いてO2になると酸素分子になり、その同じ粒が3つ引っ付いてO3になるとオゾン分子になります。」 |
 |
「分子の数え方も確認しておきましょう。」
「OもO2も酸素ですが、それらの違いは何だと思いますか。テストの時、区別できなくて困ることが多いので、ちょっとまとめておきましょう。正しく言うと、Oは酸素何とかで、O2は酸素何とかです。どちらかが分子で、どちらかかが原子です。」
「お、知っている人がいますね。Oが酸素原子で、O2酸素分子です。原子はただの粒ですが、分子は性質をもった物質になります。例えば、Oは宇宙で8番めに小さい粒に過ぎませんが、その粒が2つ引っ付いてO2になると酸素分子になり、その同じ粒が3つ引っ付いてO3になるとオゾン分子になります。」 |
 |
4 応用問題『水素の爆発』
「では、応用問題を1つだけやりましょう。水素の爆発です。マッチで水素に火をつけると
何ができるか知っていますか?」
「え、よく知っていますね。水です。水素は水のもとですから、水ができるのです。そのと
き、化合する物質波なんですか?」
水素+ 酸素→ 水
「これは簡単でしたね。酸素です。それでは、その化学反応式を順番に書いてみましょう。」
H2+ O2→ H2O
「ここまでは丸暗記です。しかし、反応の前後を比べてみると、酸素が1つ減ってしまった
ので何とかしなければなりません。次のように書ければ問題ないのですが、H2O2にする
と水ではなく過酸化水素(オキシドール、消毒液)になってしまいます。」
H2+ O2→ H2O2
「さて、ここで違う色のペンの登場です。そのペンで、それぞれの物質の前に数字を書いて
数を合わせしょう。まず、酸素を2つにしなければならないので・・・」
H2+ O2→ 2H2O
「これで酸素(原子)の数は同じになりました。酸素は解決です。しかし、反応後の水素(
原子)の数が増えてしまったので、反応前の数も増やさなければなりません。ということで、
H2の前に何と書けば良いですか?」
2H2+ O2→ 2H2O
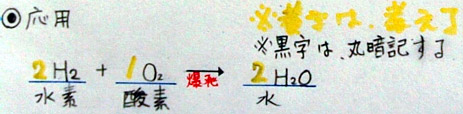
「そうですね。これでできあがりです。」
5 応用問題『過酸化水素』
理解度の高いクラスは、過酸化水素の分解についても説明した。

6 復習テスト
前回と全く同じ問題。今回で3回めになるクラスもある。

◎ A君の学習プリント
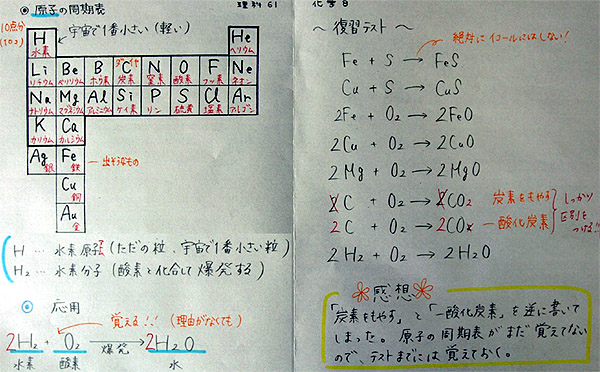
<評価基準>
1 自然事象への関心・意欲・態度
B 学習プリントに正確かつ丁寧にまとめれる
2 科学的な思考
B 原子と分子の違いをその違いから捉えることができる
3 実験・観察の技能・表現
4 自然事象についての知識・理解
B 原子番号1番から20番までを諳んじれる
B 係数2までの基本的な化学反応式を理解できる
授業を終えて
前回の授業を終えたばかりのときは、「わかった、わかった。」という声がたくさん聞かれたが、今日はダメ。原因は私ではない。生徒が家庭学習しないからである。確かに私にも責任があるけれど、生徒本人や家庭環境のそれと比較すれば微々たるものである。その証拠は、昨日学習したクラスはほとんど理解しているが、2日前、3日前にとなるにしたがって「わからない」の声が大きくなる。「わからないじゃなくて全員、丸暗記!」という基本的な復習ができてない。
↑ TOP
[→home](C)
2004 Fukuchi Takahiro