5 原子の構造
2011年10月上旬、普通教室
原子構造は、中学2年生で学習しているはずなのですが、しっかり忘れていました。大幅に予定を変更し、1時間で完了する予定のところを2時間かけました。そのうち半分は、2年生の復習です。この記録は2時間分を1ページに畳んでありますが、クラスによって進め方が違います。前ページのイオンの周期表と合わせて、合計3時間で同じ内容を学習しています。
1 今日の目標
(1) 原子の復習
(2) 原子核と電子の復習
(3) 原子番号と原子量から、任意の原子モデルを書くことができるようにする
ステップ1:原子番号と陽子数の関係について知る
ステップ2:原子番号と電子数の関係について知る
ステップ3:原子番号と中性子数の関係について知る
2 授業の流れ
(1) taka先生の驚き(5分、初めてのクラスのみ)
前時『イオンの周期表』で、1番から20番までの原子名と原子の記号を暗記している生徒がたくさんいました。私は「素晴らしい生徒達だ」と感心し、原子構造もしっかり覚えているだろうと予想し、軽く復習するつもりでした。しかし、全く覚えていないのです。原子核と電子のモデルを書くと、何だそれ? という顔をしています。まったく理解していない生徒ばかりなのです。そもそも、物質を構成する最小の粒子としての『原子(アトム)』を正しく認識していないのです。そこで、原子の復習から始めることにしました。これは、私が受け持っている4クラスとも同じです。
(2) 物質をつくる最小の材料、粒、としての原子(5分〜10分)
できるだけ長いチョークを用意して注目させ、「これは何ですか?」と発問します。「チョーク」と答えさせてから、いきなり2つに折ります。生徒は「えっ」て顔をしますが、無視して「これは何ですか?」と発問します。「チョーク」の答えが返ってきたら、同じことを何度か繰り返します。そして、黒板消しを黒板でぱたぱたして、飛び散った粉についても同じ発問をします。ここで、チョークという答えが返ってくるようにします。そして、チョークとしての最小の粒は『炭酸カルシウム』になること。それ以上分けたら、炭素と酸素とカルシウムになってしまい、チョークという物質ではなくなることを指摘します。これで、物質『チョーク(正しくは物体)』と物質をつくる最小の粒としての『炭酸カルシウム』の違い、および、物質『炭酸カルシウム』をつくる3種類の原子『炭素と酸素とカルシウム』の違いの説明は終了です。これは、2年生で学習する内容です。別ページ『分子と原子』もご覧ください。それから、『粒子』という言葉を使うと、そこでつまずく生徒がいるので、授業では『粒(つぶ)』として説明したほうが良いでしょう。そして、必要に応じて、原子は物質ではない、原子は物質としての性質をもっていない、ととりあえず説明した方が良い場合もあります。さらにまた、分子という言葉も難しいので、触れないようにすることが重要です。
上:さーて、どこまでチョークといえますか?(『分子と原子』中学校2年理科『化学』/takaの授業記録2000から)
ここから、本日のメインイベントに入りますが、4クラスでの授業実践の結果、次のような原始的方法が良いことがわかりました。あなたの学校でうまくいくかどうかは不明ですが、とりあえず、私の学校では上々でした。困っている先生は、どうぞお試しください。混乱するポイントは、通常の原子の原子核には陽子と中性子の2種類があるけれど、水素原子は中性子を持たないことです。そもそも中性子を教えなければいけないようなことを学習指導要領で決めた文科省に問題があるけれど(日本の大臣になるための資格、立候補する条件として、中性子を説明できることが必要だ。できない人は義務教育を受け直すこと。また、説明できない人は、日本の理科教育について発言する資格なし。理科嫌いをつくっているのは・・・だ、と言いたい。ああ、脱線してしまったので復帰します)、そんな不満をいってもしばらくは我慢するしかないので、次のような手順で進めてください。原子量について教えることになりますが、中性子は原子量と直結していますから、教えた方がすんなりと理解できます。原子量は、ほとんどの元素周期表に掲載されているので、うまくいくと思います。ここは、急がばまわれ、という場面です。
(1)水素原子のモデルを描く
| 陽 子 1個 | 原子核 | 原子量 1 | 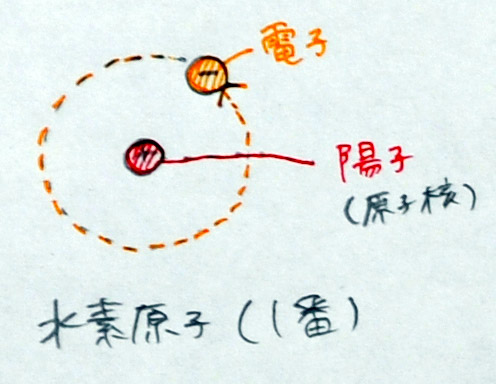 |
| 電 子 1個 | - | - |
「宇宙で1番小さい水素原子を描きましょう。水素原子は、中心に+の電気を帯びた陽子1個、その周りに−の電気を帯びた電子1個が飛んでいます。1+と1−なので、電気的にプラスマイナスゼロです。なお、陽子は中心にあるので、原子の中心、すなわち、原子核ということもあります。」
(2)ヘリウム原子のモデルを描く
| 陽 子 2個 中性子 2個 |
原子核 | 原子量 4 | 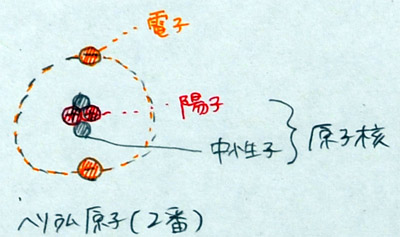 |
| 電 子 2個 | - | - |
「宇宙で2番目に小さい原子はヘリウムです。ヘリウム原子は、陽子2個と電子2個を描けば良いのですが、水素原子とちょっと違うところは、原子の中心部分、すなわち、原子核に電気を帯びていない中性子があることです。中性子は2個あります。なぜ2個なのか、という説明は後でしますから、とりあえず、ヘリウム原子のモデルを描いてください。原子核は、陽子2個と中性子2個です。その周りに、電子2個を飛ばしてください。」
(3)リチウム原子のモデルを描く
| 陽 子 3個 中性子 4個 |
原子核 | 原子量 7 | 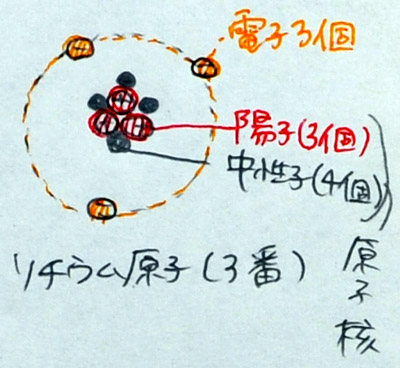 |
| 電 子 3個 | - | - |
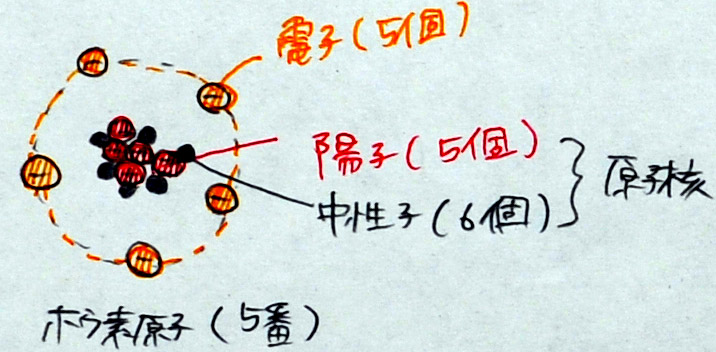
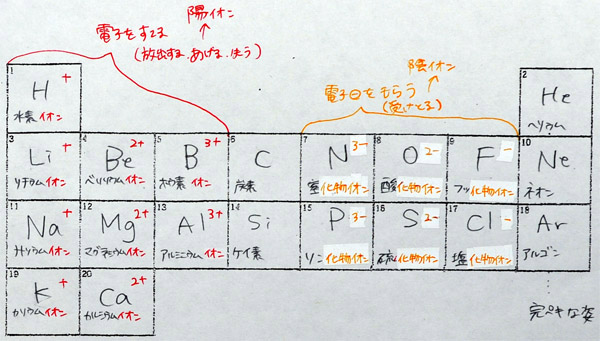
「宇宙で3番目に小さい原子はリチウムです。さて、問題です。リチウム原子の陽子と電子の数はいくつですか? これまでの流れから推測できると思いますが・・・A君・・・、さすがですね。その通り、陽子3個、電子3個です。すなわち、原子番号と陽子の数、原子番号と電子の数、陽子と電子の数はいつも一緒です。原子番号4番のベリリウムは、陽子4個、電子4個。5番のホウ素は5個5個になります。さて、ここで問題になるのが中性子の数です。水素は0個、ヘリウムは2個でしたが、リチウムは何個だと思いますか? ・・・これは調べないとわからないのですが、実は、簡単に調べることができます。理科便覧の元素周期表、または、教科書の元素周期表を出してください。(生徒が開けてから)そこに、原子番号の他に数字が書いてあることがわかりますか。水素は1、ヘリウムは4、リチウムは7です。実は、この数字から中性子の数がわかります。だれか、リチウムの中性子の数がわかった人はいますか? ・・・Bさん、さすがですね。その通り、4個です。計算式は? ・・・そうです。7-3=4。答えは4個です。原子番号と一緒に書いてある数字は、原子量です。原子量は原子の質量です。つまり、原子の重さです。水素の質量、水素の質量は1であり、ヘリウムの重さは4です。いきなり4倍になるですが、その理由は、中性子が2個あるからです。陽子だけなら2倍になるだけですが、中性子があるのですから仕方ありません。なぜ、あるのか? と疑問に思う人もいると思いますが、あるのですから仕方ありません。先生も疑問に思いますが、自然がそのようにつくったのだから仕方ありません。リチウムの重さ、原子量を調べてください。いくつと書いてありますか? そうですね。7です。宇宙で3番目に小さな原子なのに、水素の7倍の重さがあります。それは、そうなっているのですから、仕方ありません。もちろん、覚える必要はありません。入試にも出ません。安心して、この周期表を見て、調べればオッケーです。原子の原子量を読んで、そこから、中性子の数を計算できれば完璧です。大学生もそのようにしています。では、原子番号4番、ホウ素を書きなさい。できた人は手を挙げてください。先生が見に行きます。」
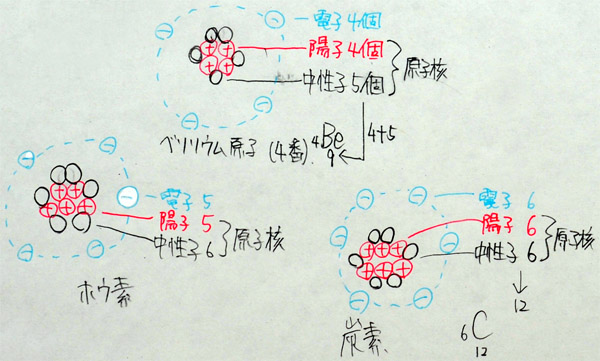
ベリリウム原子(原子番号4番、原子量9)
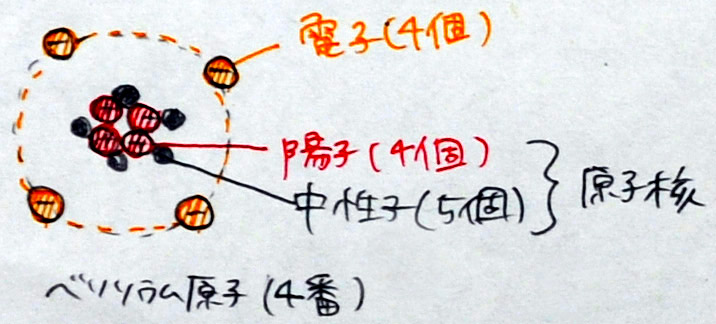
「できた人は、自分の好きな原子を2つ選び、プリントに書きなさい。」
ホウ素原子(原子番号5番、原子量11)
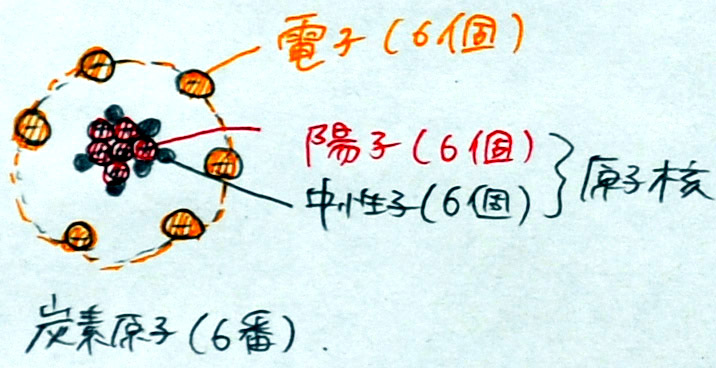
炭素原子(原子番号6番、原子量12)
以上が本日のメインディッシュです。メインだけなら20分で完了できる内容ですが、時間があまり過ぎるので、メインの味がわからなくならない程度の復習やトピック的な学習をすると良いでしょう。ただし、深入りはいけません。私の失敗例を1つ紹介すると、先頭クラスでとても高い理解度を示したので、同位体の話をしました。しかし、混乱する生徒が続出してしまいました。私の説明力不足もあると思いますが、腹八分目が大切だということです。とくに一斉授業においては、少しゆとりをもつことが重要です。以下は、とても簡単な復習をしたクラスでの学習プリントの部分です。
上:Bさんの学習プリント

上:Cさんのオリジナルなまとめ
授業を終えて
原子構造の学習は、原始的で地道な方法をとりましたが、急がば回れ。この方法が最短でベストに近い指導方法の1つだと思います。理解度はとても高く、95%以上の生徒が満足していました。どうぞお試しください。ただし、理解度が低い生徒が多い学校では、この1時間でイオンの説明をしてはいけません。原子番号1番から10番ぐらいまで、ひたすら原子モデルを書かせてみてください。1つ書くたびに合格印をあげたり、大きな周期表のマスを印刷しておいて、それにすべて記入させるような方法はどうでしょうか。そうそう、私の今年の実践では、ウランの原子を書いている生徒がいました。陽子と電子が92個ずつ、中性子が146個です。
それから、来年度から電子軌道(K核、L核、M核・・・という名称までは必要ありませんが)を教えることになります。その場合、このページだけで1時間、電子軌道で1時間確保してください。生徒の混乱が避けられると思います。私は今年、電子軌道を教えませんでした。理解度が高い学校なのでチャレンジしてみようかな、と予定はしていたのですが、危険だと判断したからです。入試にも出題されない内容なので、あえて深入りする必要はありません。ただし、電子軌道を理解させれば、原子がイオンになるときの周期性が明確になるので、化学好きが増えると思います。焦らずに、1時間ずつゆっくりと進んでください。きっとたくさんの生徒が喜ぶと思います。