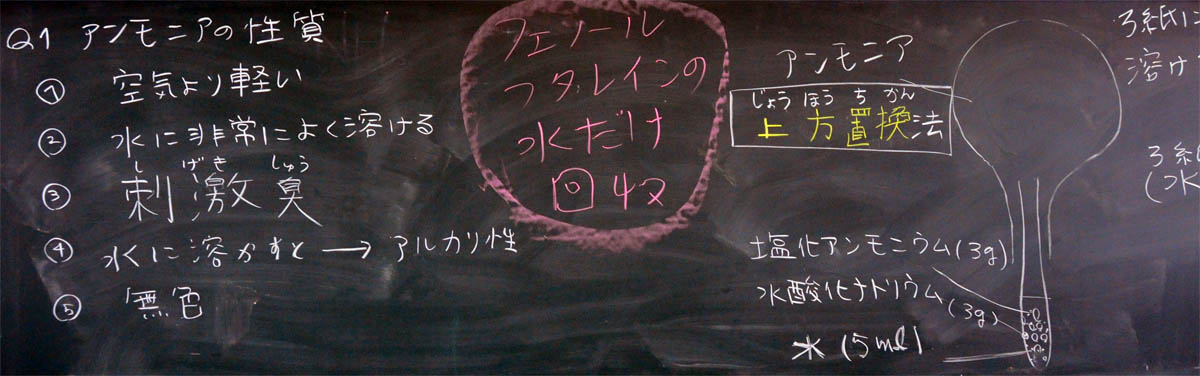本時の目標
1 アンモニアの特徴をまとめる
2 塩化アンモニウムと水酸化ナトリウムからアンモニアをつくる
3 アンモニアの噴水を成功させる
|
準 備
| 生 徒 |
教 師 |
|
|
- 本日の学習プリント (1/人)
- アンモニア水
- 塩化アンモニウム(3g)
- 水酸化ナトリウム(3g)
- 水(5ml)
- 試験管
- 丸底フラスコ(300ml)
- ゴム栓・ガラス管・ゴム管・ピペットのセット
- ビーカー(500ml)
- フェノールフタレイン
- ろ 紙
|
授業の流れ
(1) 本時の内容紹介 (1分)
(2) アンモニアの化学式の紹介 (2分)
私が担当する3クラスのうち、アンモニアの化学式『NH3』を紹介したのは1クラスだけでした。全クラス同じように紹介することは簡単ですが、画一的に揃えるのは非教育的です。NH3 は、化学式を知りたいと欲する学級だけに与えるレベルです。
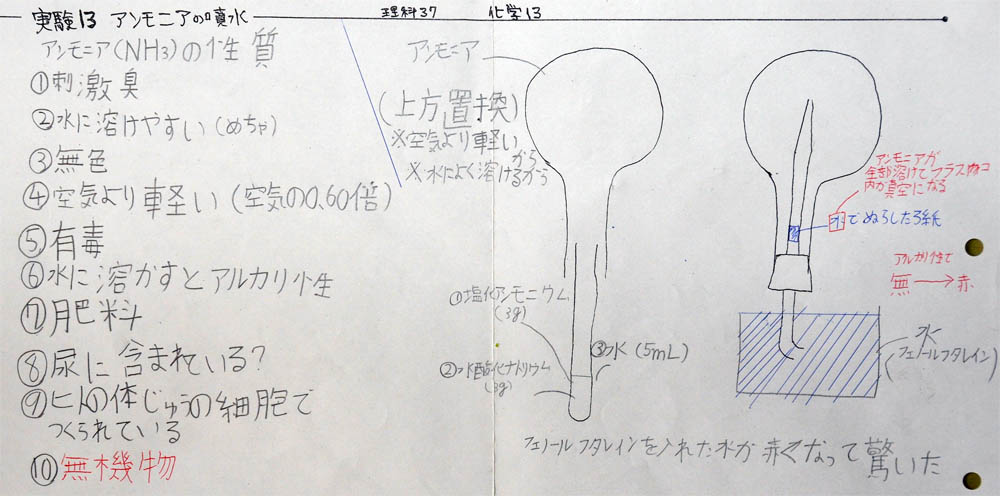
(3) アンモニアの性質 (10分)
アンモニアという言葉は有名ですが、生徒にとって親しみのある物質ではありません。しかし、時間をかけると意外な生徒が意外な発言をします。酸素、二酸化炭素、水素と同じように友達の経験を披露しあって遊ぶことができるでしょう。
上:A組の板書
空気より軽い、水に非常に良く溶ける、刺激臭、水に溶かすとアルカリ性(水酸化物イオンを生じるから)、無色・・・これらの性質はいずれも教科書に書いていあるもので面白くありませんでした。残念!

上:B組の板書
人の尿に含まれている? という意見が出ましたが、これは間違いです。尿に含まれているものは尿素で、尿素は排出させると微生物に分解されてアンモニアになります。
(4) 実験装置の確認 (3分)
先生が演示実験する前に、実験装置を確認します。アンモニアが発生すると、落ち着いた雰囲気がなくなるからです。
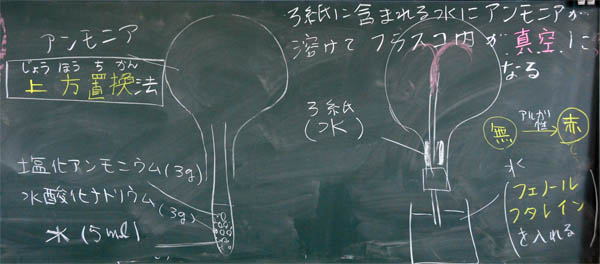
上:アンモニアの噴水の実験装置、および、噴水ができる理由
(5) 噴水、という現象が生じる理由 (5分)
これは難しい問題ですが、必ず、生徒全員がぎりぎり納得できるように指導しましょう。写真上の右上にある『穴埋め文』を見てください。『フラスコ内のアンモニアが全て水に溶けて、→ フラスコ内が真空になる』と記されています。完璧に記述するなら、さらに、→ 真空を埋めるために、何かが入ってくる → この場合、水が噴水のように重力に逆らって入ってくる、となります。が、このクラスでは口頭による説明に止めました。
(6) 演示実験 (5分)
噴水は100%成功させてください。ただし、アンモニアを発生させる段階では、いくつかの失敗を示し、安全対策を十分に行ってください。
(7) 生徒実験 (20分)
手際良い班は、5分で成功させます。数回くり返し行わせてもよいでしょう。ただし、2回目はフラスコ内に水がついているので、アンモニアを充満させるために『アンモニア水』を使います。その手順も、(6)の演示実験で示しておきます。
 |
→ |
 |
上:塩化アンモニウム(3g)、水酸化ナトリウム(3g)、水でアンモニアを発生させる様子
ポイント1:塩化アンモニウムと水酸化ナトリウムの反応熱は大きいので、手で持たない
ポイント2:フラスコの重さで、試験管立てが倒れないように両手で固定する

上:フラスコに捕集したアンモニア
フラスコ内部が白いのは、反応熱で気化した水(アンモニア飽和水溶液)が付着しているのではないか、と思われます。詳細は不明なので、ご存知の方は教えてください。よろしくお願いします。
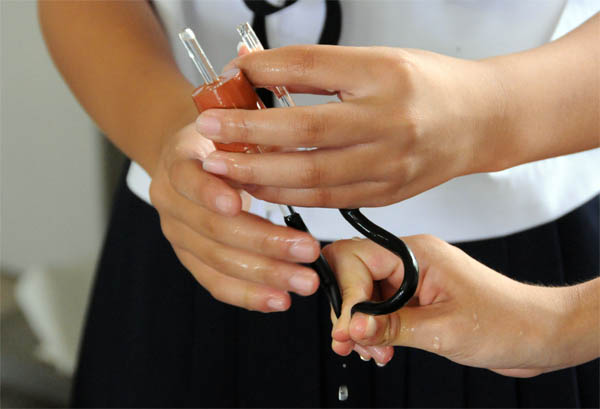
上:ゴム栓、ガラス管、ゴム管セットに水を充満させている様子
ポイント2:水道の蛇口から水を流し、それに直接ガラス管を当ててセット内部に水を通す。水が流れている間に、ゴム管を半分に折り、しっかり押さえる。押さえたままなら、どのような状態にしてもセット内部の水はなくならないので、そのままフラスコの口にゴム栓を取り付ける。取り付けたら、反対側のガラス管を500mlビーカー(フェノールフタレイン入りの水)につけ、手を離す。10秒ほどで噴水が始まる。始まらない時は、フラスコを逆さまにしてゴム管を扱き、フラスコ内に水を入れる。数ml入れば、自動的に噴水が始まる。始まらない場合は、どこかにすき間があるので、実験装置全体を点検すること。

上:手際のよい操作で噴水をつくった生徒

上:見事な噴水で大成功!
上:生徒の学習プリント
授業を終えて
事故なく安全に楽しくできて、ほっとしました。
note1:アンモニアを水に溶かした時の電離式
アンモニアそのものは酸性でもアルカリ性でもない! という重要ポイントは、1年生の学習内容として限り無く間違いです。それでも、現象としては面白いので、押し切ってください。面白い実験は、常に最優先されるべきです。逆に、実験しない=論外です。
| NH3 |
+ H2O |
→ |
NH4+ |
+ OH- |
| アンモニア |
+ 水 |
→ |
アンモニウムイオン |
+ 水酸化物イオン
(アルカリ性) |
note2:アンモニアの水に対する溶解度(753ml/ml-H2O)
気体のアンモニアは、水1mlに対して753ml溶けます)。したがって、理論上は、500mlフラスコに充満した全てのアンモニアを水1mlに溶かすことができます。
関連ページ
・実験6 アンモニアの噴水 1年(2002年)
・アンモニアの噴水 1年(1999年)
実践ビジュアル教科書『中学理科の化学』
| 第3章 分 子 |
大気に含まれる物質 |
p.30 |
| 気体の集め方 |
p.33 |
| アンモニアの噴水 |
p.36、p.37 |
|
| 第7章 イオン |
いろいろなイオン |
p.116 |