|
準 備
| 生 徒 | 教 師 |
|
|
授業スナップを中心にした記録
濃硫酸による脱水反応の演示実験 500mLビーカーを用意します。その上に『濡れぞうきん』を載せますが、ぞうきんに含ませる水分量は多い方が良いでしょう。ぞうきんを絞って滴り落ちるようではいけませんが、それに近いぐらいの絞り方です。ぞうきんは2つ折にして載せます。ビーカーの内部が見えるような掛け方、にすると見所が増えます。 滴下する濃硫酸は、5mLピペットに3mL入れてください。それを1滴ずつ滴下します。ぞうきんの落ちるたびに、「じゅっ」「じゅわっ」と音がします。その音を聞いた子どもたちは一様に驚きます。その音を聞くように指示してください。静寂と集中の世界になります。
|
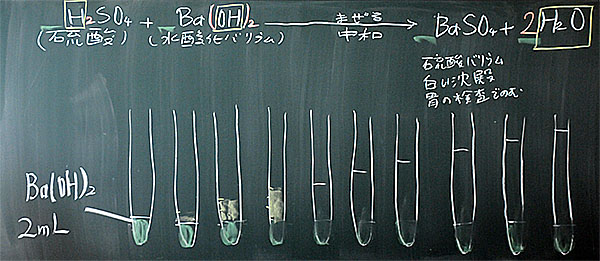
図4:化学反応式と実験方法

図5:化学反応式と実験結果(BTB液の色変化)

図6:同上(別クラス)

図7:手順の板書

図8:成功のポイント
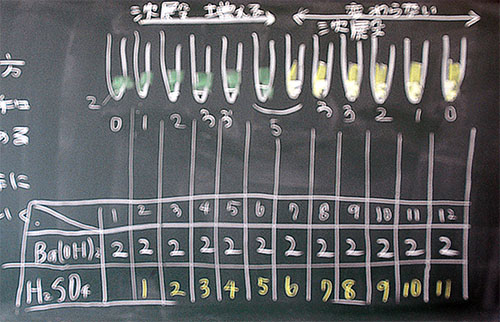
図9:手順を詳細に書いたクラスもある(ピンボケごめん!)
水酸化バリウム水溶液を濾過させる
しかし、私は生徒の目の前で水溶液を作ります。薄いものしかできませんが、濃度が均一なら大丈夫です。ただし、溶かしたばかりのものは白濁しているので、図10のように濾過させてください。無色透明の水溶液が得られます。図10が青色になっているのは、BTB液によるものです。きれいでしょ! また、前日に作った水酸化バリウム水溶液は、その表面に白い膜ができています。その膜は空気中の二酸化炭素と反応してできた『炭酸バリウム』です。これを除去するためにも、簡易な濾過をさせてみてください。1分〜2分の操作ですが、子どもたちにとっては大きな経験です。 なお、この操作については別ページ『H2SO4とBa(OH)2の中和3年(2011年)』もご覧ください。 |

図11:水酸化バリウム水溶液を2mLずつ入れる(試験管12本)

図12:次に、希硫酸を1mLずつ入れていく

図13:同上

図14:完成!
図14はできたばかりです。左から順に、水溶液の量が増えていることがわかります。水酸化バリウム水溶液の量は同じですが、希硫酸の量を増やしていったからです。
水溶液の色については、左が青(アルカリ性、水酸化バリウム水溶液の性質)、中央が緑(中性)、右が黄色(酸性、硫酸の性質)であることがわかります。
また、水溶液は透明でなければ、水溶液と言いません。図14を見ると、左端1本をのぞいて白濁しています。これは、中によってできた硫酸バリウム(水に溶けない沈殿物)が水溶液中をただよっているからです。しばらく放置すると沈殿し、すべて透明な水溶液になります。図15を見てください。

図15:1日放置したもの
図15の観察ポイントは、沈殿量です。左から順に増えていますが、緑色以降は同じになります。・・・はずです。はずです、というのは、図15に『→』を2箇所入れましたが、本来はここになるべきですが・・・原因不明。緑色以降はうまくできています。
この授業のまとめとして、図15のような結果(沈殿量)になる理由を考え、対話し、まとめます。

図16:限定要因についてまとめた板書
===

図17:完成作品
この学級では授業時間の関係で、同じ実験を2回行いました。2回目は、各班で水溶液の濃度を調節させました。初回は試験管5〜7本目で中和するように調整したものを配布しましたが、今回はやや濃いものを配布しました。そして、12本の試験管に入れていく前に、2つの水溶液の濃度を同じにするように指示しました。そしてできたものが、図17です。
濃度調節のため、水溶液はどんどん薄くなっていくので、図17は私がBTBを追加しました(図18)。
図18:試験管12本にBTBを手早く入れる様子



