19 H2SO4とBa(OH)2の中和
2011年11月上旬、理科室
前時につづいて、中和実験を行います。今日の特徴は、中和でできた塩『硫酸バリウム』が水に溶けないこと、沈澱することです。沈澱量をみれば、どれだけのイオンが反応したか一目でわかるのです。たくさん沈澱すれば、たくさんのイオンが反応したことがわかります。それでは、反応させる水溶液の量をかて、沈殿物の量との関係を調べてみましょう。
関連ページ
硫酸と水酸化バリウムの中和 2002年9月(1年)
実験13 硫酸と水酸化バリウムの中和(3年)2001年
中和するときのイオン量(3年)2001年 ← 電流計を使った実験
実験15 中和するときの量(3年)2001年
本時の目標
(1) H2SO4とBa(OH)2の中和反応式を正しく理解する
(2) 本日できる塩(えん)『BaSO4(硫酸バリウム)』について理解する
(3) 実験の目的と方法と知る
(4) 実験する
(5) 片付けて、まとめる
授業の流れ
| 1 H2SO4とBa(OH)2の中和反応式を正しく理解する(7分) 2 BaSO4(硫酸バリウム)について理解する(3分) 3 実験の目的と方法を知り、実験する(30分) 4 片付けて、まとめる(10分) |
授業の様子
1 H2SO4とBa(OH)2の中和反応式を正しく理解する(7分)
前時と同じように、次の式を確認する。
H2SO4+Ba(OH)2 → BaSO4+2H2O

上:自主的に中和反応式に書きに来た生徒達
2 BaSO4(硫酸バリウム)について理解する(3分)
H2SO4の主な特徴は、以下の通り。
(1) 硫酸と水酸化バリウムの中和によってできる塩
(2) 水に溶けない=沈澱する物質
(3) 白色
(4) 比較的安定した物質
(5) 胃のレントゲン撮影のときに飲む『バリウム』はこれ!
(6) 非電解質

上:板書
3 実験の目的と方法を知り、実験する(30分)
実験の目的は、反応させる水溶液(イオンの量)を変化させ、沈澱の量がどのようになるか調べる。沈澱量の変化から、反応したイオン、反応しないまま水溶液に残っているイオンについて考察することである。

上:板書
水酸化バリウム水溶液の量を一定(2ml)にして、加える硫酸の量を1ml刻みに変化(0〜9ml)させる。
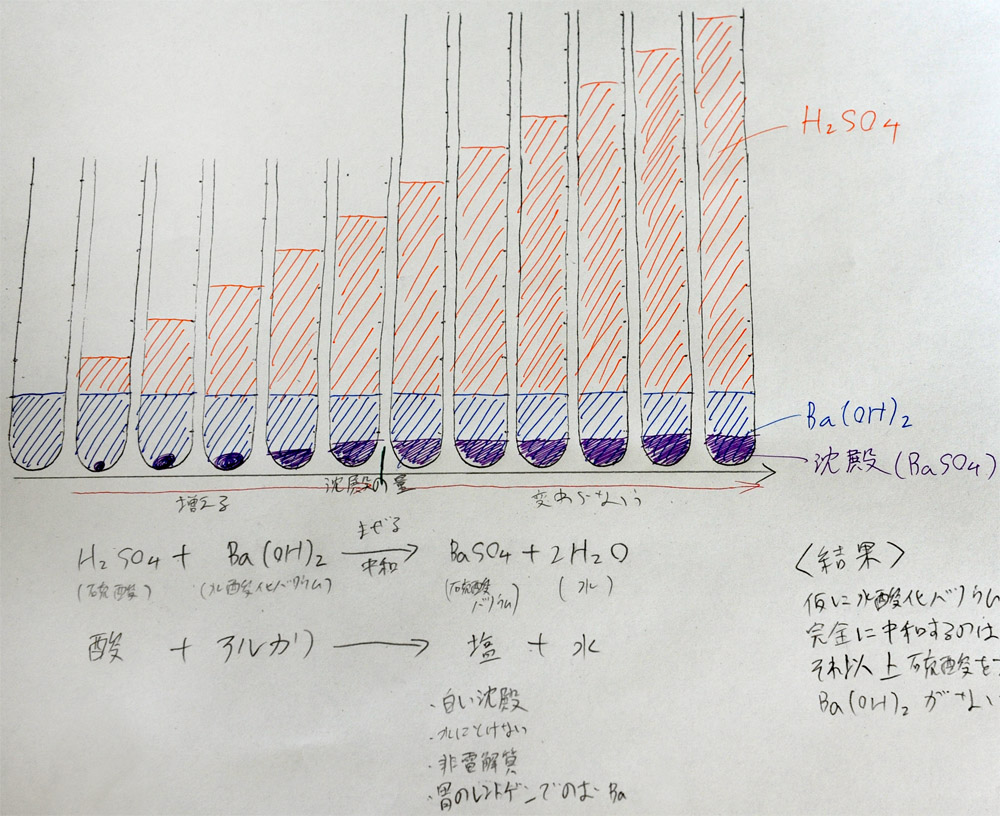
上:実験後のA君の学習プリント
中和点以降は、沈澱量が変わらないことが示されている。
水酸化バリウム水溶液の準備
水酸化バリウムは水にあまり溶けないので、飽和水溶液を準備するべきである。しかし、実際の授業で十分な量(4クラスなら2リットル)を準備することは現実的ではないので、その方法で準備する。生徒にろ過させることで、実験の楽しみも1つ増える。
(1) 事前に水酸化バリウム10gを水500mlに入れておく
(2) (1)の表面にできた白い膜『炭酸バリウム』を紹介する
※炭酸バリウムは、空気中の二酸化炭素とバリウムが結合したもの
(3) (1)を生徒の目の前で十分にかき混ぜ、混濁させる
(4) (3)にBTBを入れ、青色にする
(5) (4)をろ過して、青色透明にする
(6) (5)を2mlずつ10本の試験管に入れる
※この演示操作は、鮮やかに1分以内で完了すること硫酸の濃度の調節する様子を見せる
生徒の目の前で濃硫酸を薄めて濃度を調節し、硫酸に含まれるイオンの量がイメージさせることは、本時の目標を達成するために非常に重要なすてっぷになる。その方法は次の通り。
(1) 水500mlをビーカーに入れる
(2) 濃硫酸1.5mlをピペットで加える
(3) 丁寧にかき混ぜる
(4) 教師の手に薄めた硫酸をかけ、手についても大丈夫なことを示す
※すみやかに流水で流すことも塩辞すること
(5) (3)を水酸化バリウムが入った試験管に1ml入れる
(6) (3)を次の試験管に2ml入れる
(7) (3)を次の次の試験管に3ml入れる
(8) (3)を次の次の次の試験管に4ml入れる
(9) おそらく、(8)の試験管(硫酸4ml)で青色から黄色に変わると思うので、ここで次のように解説する。「硫酸が少し濃かったようなので、水の量を20%ほど増やします。そうすれば、次の試験管のとの間、つまり、4本目と5本目で変化する、中和するようになると思います。水溶液に含まれるイオンの割り合いを減らすわけです。」
 |
. |  |
上2枚:水酸化バリウム水溶液のろ過。ろ過する前のビーカーの表面にある白い物質は炭酸バリウム(二酸化炭素と化合したもの)であり、硫酸との中和からできる硫酸バリウムとは違う。
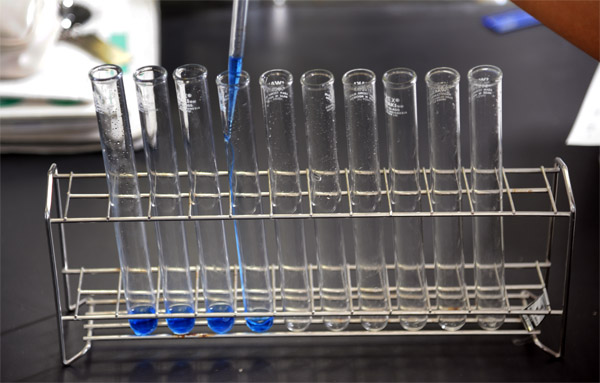
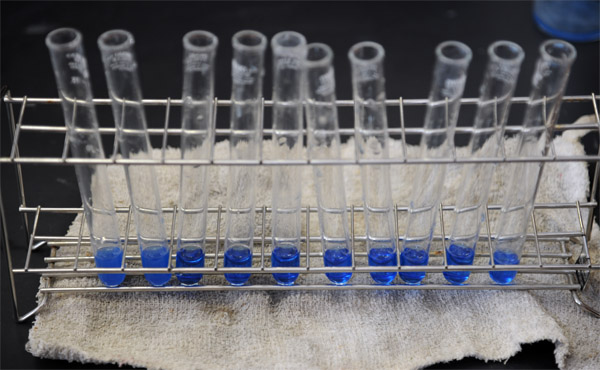
上2枚:水酸化バリウムを2mlずつ取りわけた試験管

上:硫酸を加える様子

上:撹拌する様子。ガラス棒を使う方が良い。
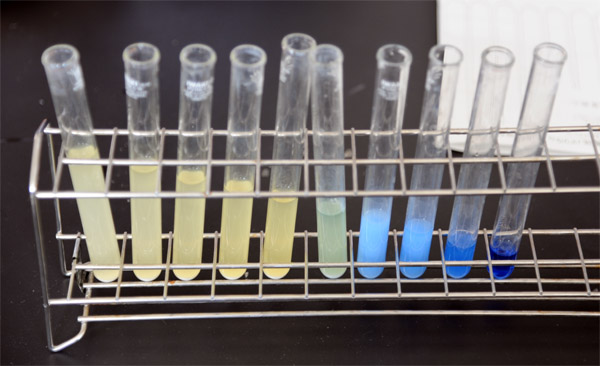
上:緑色の試験管ができた班

上:硫酸バリウムの結晶をつくり、観察する生徒
4 片付けて、まとめる(10分)

上:友達の前で説明する男子生徒


上2枚:板書と実験結果

上:A君の考察
授業を終えて
簡単な実験なので、時間は十分にあります。10本の試験管をつくったら、試験管以外をかたづけさせ、生徒に実験結果の考察をさせると良いでしょう。頭の中ではなんとなくわかっても、言葉にして説明したり、文字にしてまとめるのは難しい内容です。
|
HClとNaOHの中和 |
いろいろな塩をつくろう |
