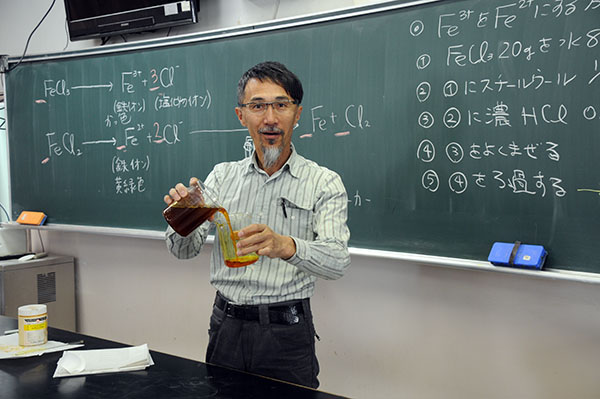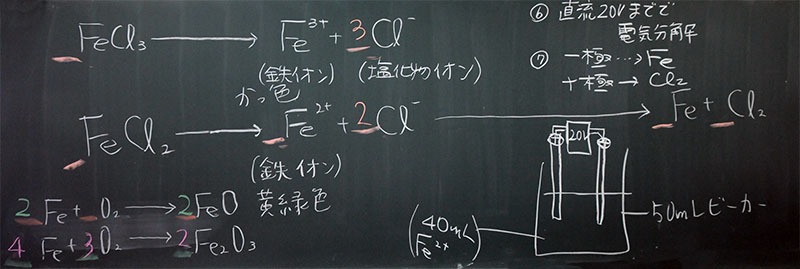第72時
実験16 塩化鉄の電気分解
2018 11 20(火)、21(水)
第2理科室
はじめに
すべての金属は電子を失い、プラスイオンになる特性を持っています。鉄の場合、失う電子の数は2個と3個の場合があり、2個失った場合はFe2+(Ⅱ)、3個失った場合はFe3+(Ⅲ)になります。どちらになるかは条件によって変わるだけでなく、それらが複合した形(構造)になるので、鉄は難しい金属の1つとして有名です。
中学で学ぶ鉄、鉄イオン、酸化鉄
身の回りによく見られる鉄は、詳しく学習したい金属の1つです。中学では硫黄と化合させたり、スチールウール(鉄)を空気中で加熱し、酸化鉄をつくったりします。スチールウールの加熱では、その質量が増加すること、増加量=酸素量であること、を学びます。その変化は『鉄+酸素→酸化鉄』ですが、化学反応式で表すことは困難です。問題点は鉄イオンの価数が2つあることです。1つはFe2+(Ⅱ)、もう1つはFe3+(Ⅲ)です。そして、さらに大きな問題点は、鉄は単純な酸化反応をするのではなく、複雑な反応をする(結晶構造をつくる)ことです。酸化鉄の種類は、ウィキペディアで16種類紹介されています。
次に、チャンスがあれば授業で教えたいものをまとめます。
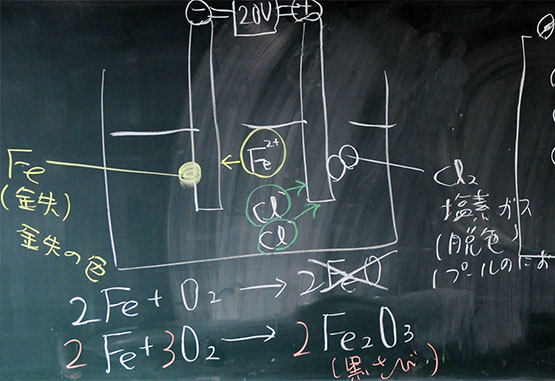
鉄の酸化(酸素不足の場合)
鉄イオン:Fe2+
酸化鉄:FeO(Ⅱ)
2Fe + O2 → 2FeO
鉄の酸化(酸化十分の場合)
鉄イオン:Fe3+
酸化鉄:Fe2O3(Ⅲ)(三酸化二鉄)(赤さび)
4Fe + 3O2 → 4Fe2O3鉄鉱石(ヘグマタイト)
鉄イオン:Fe2+ & Fe3+
酸化鉄:Fe3O4(四酸化三鉄)(黒さび)(鉄鉱石の主原料の1つ)
鉄製品を酸素や水による腐食から守るために、Fe3O4で表面をおおうことがよくある。さらに、Fe3O4の表面は、Fe11O16(16酸化11鉄)であると仮定すると上手くシミュレートできる、という報告もあります(出展)このように、実際の酸化鉄は非常に複雑で、中学生の手におえるものではありませんが、私は鉄原子や鉄イオンについて、できる範囲で学習させたいと思います。本時の実験は、鉄イオンの不思議さ、色の美しさに触れることができます。金属イオンの価数が1つではないことを紹介するために、時間があれば実践したい授業の1つだと思います。
このページは本年度の授業スナップを中心にまとめます。詳細は7年前の実践『塩化鉄の電気分解3年(2011年)』をご覧ください。

図1: 塩化鉄(Ⅱ)水溶液をつくり、電流を流す