���_�̓d�C�����̂�����
2001�@5�@14�i���j
2005�N4���NjL
�����́A����s�������_�̓d�C�����̂����݂����f�����g���čl���܂��B�����ł����ǂ���A������x�A���������ăC���[�W��蒅�����܂��B
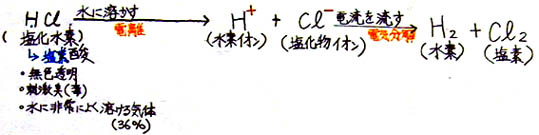
�i��F�`�N�̊w�K�v�����g�̂܂Ƃ߁j
���@�����摜���܂܂�Ă���2000�N�x�̎��H�w����11���_�̓d�C�����x���Q�l�ɂ��ĉ������B
�����Ƃ̗��ꁄ
�P�@���_�̓d����

�i��F�a����̊w�K�v�����g�j
 �����k�̂��߂̃����|�C���g�E���b�X���� �����k�̂��߂̃����|�C���g�E���b�X����
�@���q�A�C�I���i���q���{��|�̓d�C��тт����́j�A���q�̋�ʂ��ł��Ȃ��Ȃ��Ă��鐶�k����������w���̏ꍇ�́A�E�̂悤�ɁA�R�҂��܂Ƃ߂Ă��Ɨǂ��B��ʂɁA���f�����f���q���Ӗ�����B |
�����_�ɂ��ā�
�E�@���_�̐������̂́A�������f
�E�@���q���́A�g�b��
�E�@�퉷�ŋC��
�E�@���ɗn����i�R�T���^�P�O�O���j
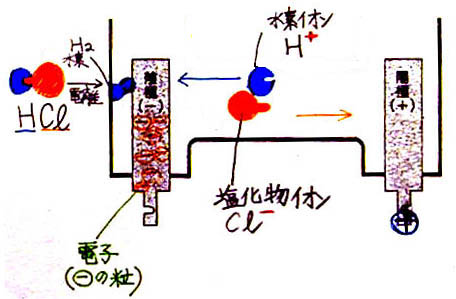
�E�@�d�����i�n����ƃC�I���ɂȂ�j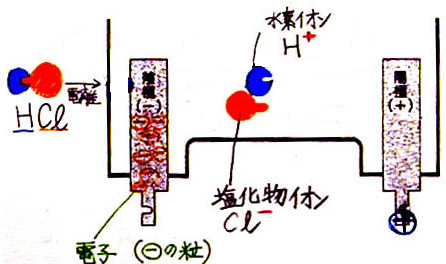
�Q�@�������f���n�t�ɓd���𗬂�
�P�j�@�|�ɂɂ͓d�q�����܂��Ă��邱�Ƃ��m�F����
�Q�j�@�|�ɂցA���n�t���́{�C�I���i���f�C�I���j���ړ�����
�R�j�@���f�C�I�����d�q�������Đ��f���q�ɂȂ�
�S�j�@���f���q�Q���������āA���f���q�ɂȂ�
�T�j�@�t�ɁA�{�ɂցA�������C�I�����ړ����ĉ��f���q�ɂȂ�
�U�j�@���f���q�Q���������āA���f���q�ɂȂ�

 �R�@���k����
�R�@���k����
�����́A����s�������_�̓d�C�����Ɠ����ł��B�������A�Q��߂̂Ȃ̂Ŏ�ۂ悭�������i�݂܂��B�P�T��������Ώ\���ł��傤�B���ۂ̎��Ƃł͖��̔ǂ��������s���܂������A�ǂ̔ǂ����f�K�X�Ɖ��f�K�X���m�F���邱�Ƃ��ł��܂����B�E�̎ʐ^�Ő������܂��ƁA�����̓d�Ɂi�|�ɁA�������[�h���j����͔��������鐅�f�K�X���������Ă��܂��B�E�̓d�Ɂi�{�ɁA�Ԃ����[�h���j���甖���ΐF�̉��f�K�X���������Ă��܂����A���f�K�X�͐��ɑ��Ĕ��ɗn���₷�������������Ă���̂ŁA���܂�W�܂��Ă��܂���B���k�́A���f�K�X�Ƀ}�b�`�̉����ߕt���Ĕ�������������Ԃ��Ă��܂����B�܂��A��Еt���̎��ɁA�v�[���̏��ʼnt�̏L�������Ȏ��ɏ[�����邱�Ƃ���Ȍo���ɂȂ�܂��B��������炸�ɁA�m�[�g�ɂ܂Ƃ߂邾���̐��k�ɂƂ��Ă����ƏL���ɂ�镜�K�����҂ł��܂��B
�S�@�܂Ƃ�

���Ƃ��I����
�@���_�̓d�C�������I�������ɁA�{�����s���Ηǂ������B
�@���k�B�����܂�Ɏ�ۂ悭�������s���A�������A�v�����g�ɂ�������̔������܂Ƃ߂Ă���̂ŁA���͊ȒP�ɂ܂Ƃ߂�����Ηǂ����낤�A�Ɗ��Ⴂ���Ă��܂����B�����Ɏ���܂ŁA�R�N�����w���삪���낤�낵�Ă��܂�������ǁA�ŏI�I�ɂ͗������[�܂����̂ł͂Ȃ��Ǝv���B�����͓d�C�����̉��p�Ƃ��āA�H�����̓d������B���̌�A���w�d�r�̊w�K�����āA�P�w���̒��ԃe�X�g���}�������B�ǂ��܂Ő��k�̗������i���y���݂ł���B