| このページは中学校2年理科『化学』/takaの授業記録2003です |
実験2 銅と硫黄の化合(硫化)
2004 1 23(金)
第1理科室
今日は危険です。前回よりも危険です。mr. takaの予備実験では問題なかったのですが、生徒が行うと何らかの操作ミスがあるようで危険です。加熱すると、一瞬のうちに反応することがあります。爆発です。
警告! 一般の中学校では絶対にやらないで下さい
それでもやりたい先生は少なくとも20回以上、万全の予備実験してから、先生による演示実験としてください。
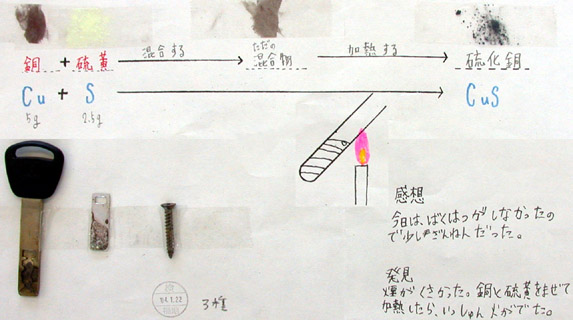
銅+ 硫黄→ 硫化銅
Cu+ S→ CuS
(写真右)反応後の試験管内部。反応しなかった硫黄と化合してできた(青みがかった)黒の硫化銅が観察できます。
|
 |
参考資料: 2015年の実践例『個人で実験をする』鉄と硫黄の化合(安全な実験)
参考資料: 松田先生から紹介して頂いた鉄と硫黄の化合(安全な実験)

(上:上の画像をクリックすると爆発の瞬間が見られます)
<授業の流れ>
0 始業前の準備
前時と同じ手順で準備します。つまり、理科室に移動してきた生徒から順に、適当な量の
銅と硫黄を配付します。時間があれば、鉄製スタンドやガスバーナーなどの器具もチャイム
が鳴る前に用意させます。
1 前時の復習
学習プリントの裏に、前時の化学反応式を書かせ、その場で答え合わせをします。反応式
は=(イコール)ではなく、→(矢印)で表わすことを確認します。A+B=ABではなく、
A+B→Cなのです。1+2=3は間違いです。
| 正 |
誤 |
鉄+硫黄→硫化鉄
1+2→ コーヒー
A+B→ C |
鉄+硫黄=硫化鉄
1+2=3
A+B=C |
2 本時のねらい、よりも注意!!
1 銅と硫黄を混合し、加熱するとどうなるか実験する
銅 + 硫黄 (混合し加熱する)→ ?
銅 + 硫黄 (混合し加熱する、化合・硫化)→ 硫化銅
2 爆発する可能性がある、非常に危険な実験
3 試験管の口の方向から3メートル以上離れて下さい
4 隣の班が実験している時は、その班に注目して下さい
5 2つの班が同時に加熱しないで下さい
6 新品の試験管を使用し、不純物の混入を避けて下さい
7 反応してできた物質について、試験管を割って取り出して調べて下さい
8 とにかく、危ないので声を掛け合い、事故のないように注意しあって下さい
3 鉄と硫黄について
1 鉄と硫黄の単体を紹介し、それぞれの性質をまとめさせる
2 実物を学習プリントに添付する
4 生徒実験
1) 鉄と硫黄の計量
鉄4gと硫黄2gを、電子てんびんで測り取る(もっと少ない方が安全です)。
2) 銅と硫黄を混合する
乳ばちの中に不純物が入っていないか注意して下さい。
3) 混合物を試験管に入れる
4) 混合物の一部をプリントに添付する
加熱後の混合物と比較するためです。
5) 試験管を鉄製スタンドに固定する
(1) 斜め45度にし固定する
(2) ガスバーナーと試験管の位置や高さを調節する
(3) 加熱する位置は、混合物の最上部にする
6) 混合物を加熱する
(1) 試験管からガスバーナーを外して、火をつける
(2) 炎を中火にする
(3) クラス全員に声をかけ、先生の許可を得る
(4) ガスバーナーを動かして、炎を混合物の最上部に当てる
(5) 全員、退避する
・ 試験管から2メートル以上離れる
・ 試験管の口の方向からは完全退避
7) 反応の様子を観察する
8) 反応が終わった試験管を冷やす
9) 試験管を割り、中の物質を取り出す
10) 反応後の物質(硫化鉄)を調べる

(上:試験管から取り出した物質を調べる生徒)
5 本時のまとめ
鉄 + 硫黄(混合し加熱する、化合・硫化)→ 硫化鉄
Fe+ S→ FeS
ただし、次のように2段階に分けて記述したほうがよい。
第1段階: 銅+ 硫黄(混合する)→ ただの混合物
第2段階: ただの混合物(加熱する)→ 硫化銅
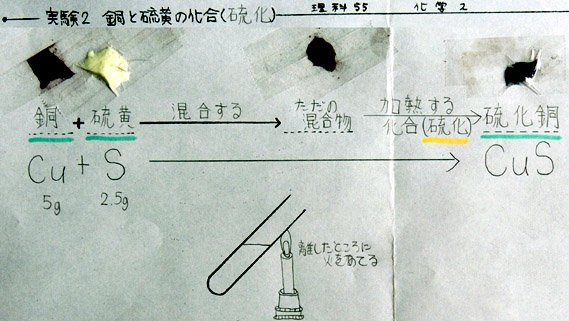
◎ D君の学習プリント
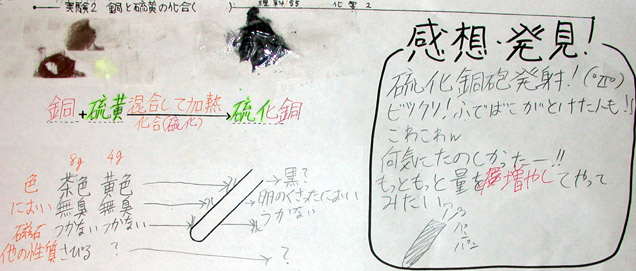
◎ Eさんの学習プリント
プリントの左下に添付してある鍵やネジなどの金属は、Bさんが自宅から持参したもの。
これらの金属に少量の硫黄を乗せ、ガスバーナーで直接加熱し、それらの金属が硫化す
るかどうかを調べた。
<評価基準>
1 自然事象への関心・意欲・態度
B 本時の実験学習内容を、丁寧かつ正確にまとめることができる
2 科学的な思考
A 激しい発熱反応が起こる原因を推測することができる
B 銅と硫黄の混合物と、それを加熱したものが別な物質であることを理解できる
3 実験・観察の技能・表現
B 銅と硫黄の化合物を加熱して、硫化銅を作ることができる
B 学習プリントに、銅と硫黄と硫化鉄を添付することができる
C 安全に実験を行うことができる
4 自然事象についての知識・理解
B 銅の硫化について、正しく理解することができる
授業を終えて
本当に死ぬかと思った。初めのクラスでは実験を3回中断し、その度に全員席につかせて
から私の指導のもと加熱した。それでも、吹きこぼれることがあり、しかもハッキリした原
因は分からなかった。授業を終えてからさらに予備実験を繰り返し、鉄より激しい発熱反応
で、反応時間が短いこと、反応すると体積が20%増えることが分かった。
混合物の一部に反応が始まると、一瞬とまでは言えないまでも、猛スピードで連鎖的に反
応が進む。直径18ミリ試験管に混合物5センチ入れてその最上部を加熱した場合、反応開
始から約1秒で終わる。しゅうううう、と音を立てて最後まで綺麗に反応する。数回、繰り
返して観察しないと、連鎖的に反応していることが分からないくらい速い。意識をもって観
察を繰り返し、鉄と硫黄の反応と同じであることを確認したい。
安全かつ綺麗に反応させるためのポイントは、混合物のごく一部だけを加熱することであ
る。これまでの説明では『混合物の最上部』と記述してきたが、実際は、混合物より上の『
何もない部分』を加熱し、試験管を伝わってくる熱で初期反応を引き起こすと良い。反応前
前の混合物の温度を低くしておくことも大切である。尚、鉄を硫黄の反応は、銅と硫黄の反
応と比較すれば非常に安全な実験である。
上の実験は、最後のクラスでの実験の様子。混合物の量や加熱する位置を十分に研究すれば、
これぐらいの爆発実験は各班で行うことができるようになる。ただし、 1回1回、確実に教
師が監督すること。爆発の程度をだんだん大きくしていき、生徒全員がその危険性を認知し
て自主的に避難できることが条件である。それができるということは、実験内容を熟知して
いるということである。
<実験データ>
・ 新品の試験管
・ 銅3g、硫黄6g
→ 銅:硫黄= 1:1
→ 銅4g、硫黄8gで実験すると確実に吹きこぼれる
・ 加熱する位置は、次のように変化させていく
混合物の上の何もない部分→ 混合物最上部→ 混合物上部→ 混合物中央→ 混合物下部
・ すると、反応速度が上がっていく
・ 吹きこぼれたもを観察させ、反応せずに残っているものがあることにも着目させる
再警告! 一般の中学校では絶対にやらないで下さい
参考資料: 2015年の実践例『個人で実験する』鉄と硫黄の化合(安全な実験)
参考資料: 松田先生から紹介して頂いた鉄と硫黄の化合(安全な実験)
↑ TOP
[→home](C)
2004 Fukuchi Takahiro
