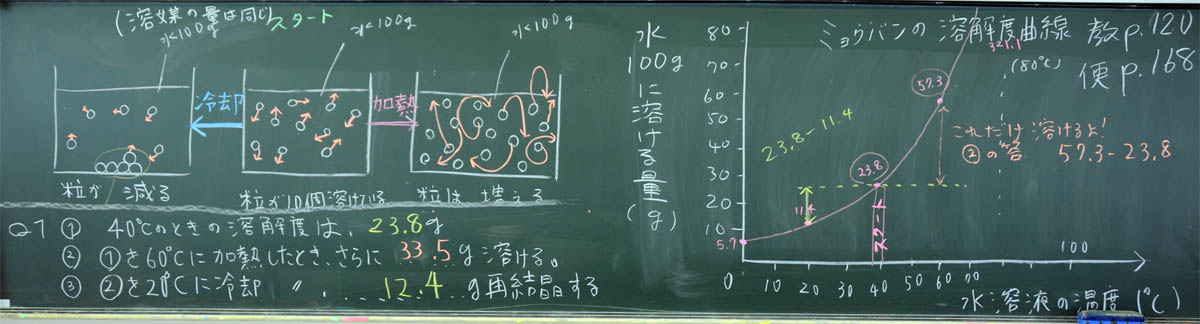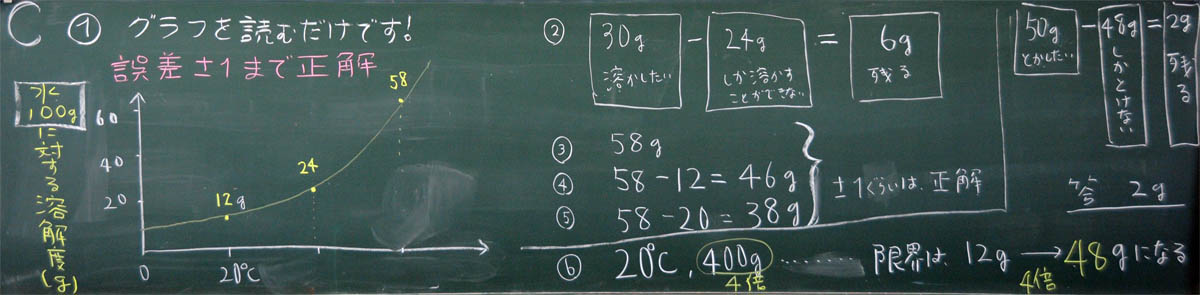|
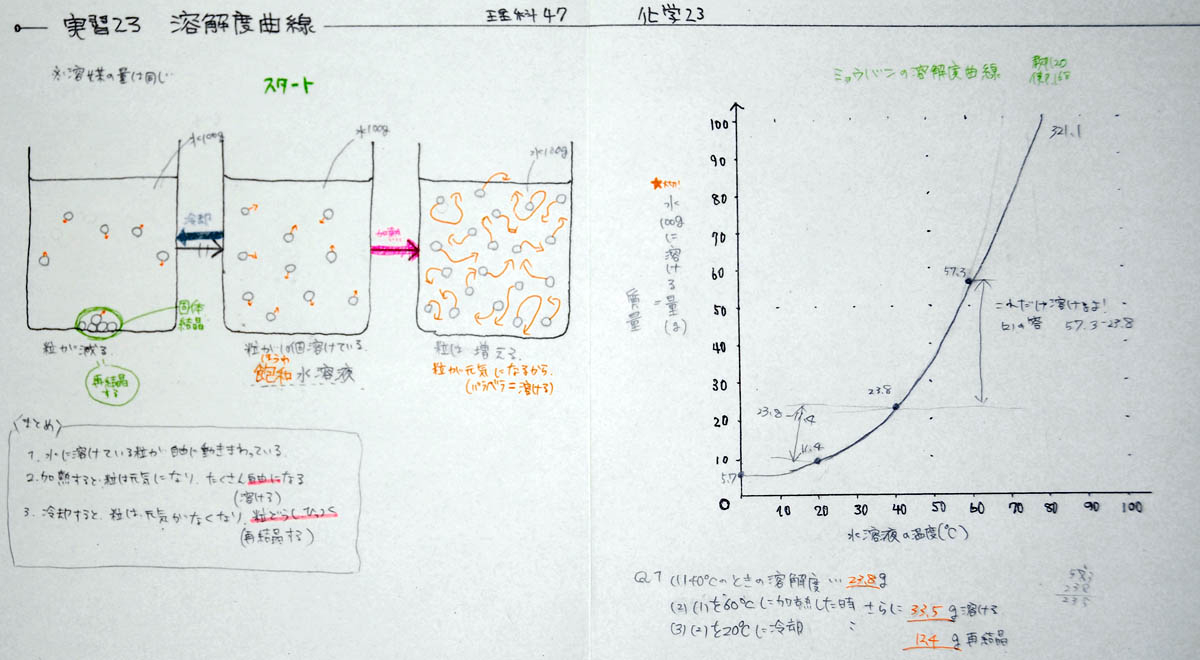
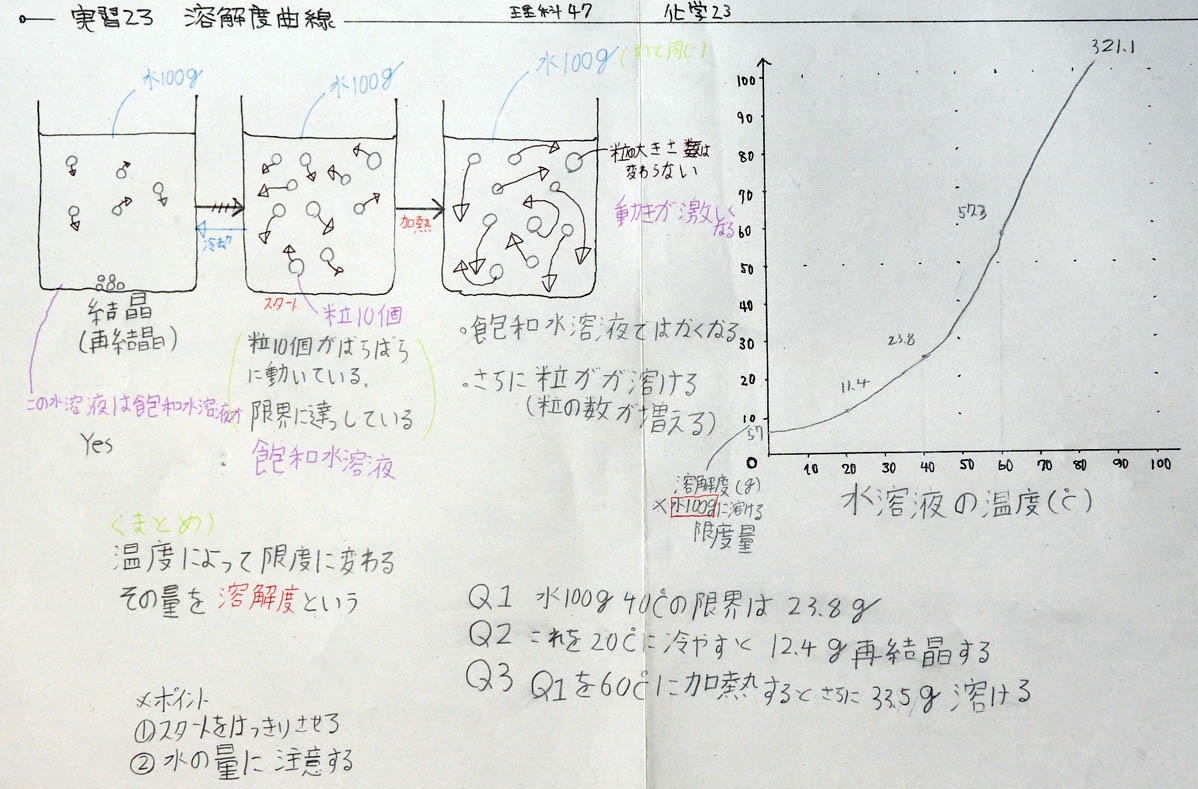
1) ミョウバンの溶解度曲線を書く
「いよいよ本日のメインディッシュ、溶解度曲線です。名前は難しそうですが、実は簡単です。1本の曲線をグラフに描くだけです。物質は何でも良いのですが、食塩は温度によってほどんど変わらないので止めましょう。分りにくい曲線になります。砂糖やミョウバンや何でも良いけれど、もしかして、誰か、希望する物質はありますか! ・・・ないようなら、テストに良く出る物質を使いましょう。テストに役立ちますからね。A君、教科書では何を使っているか調べてください。ほら、みんなも探して! 何ページにありますか。」
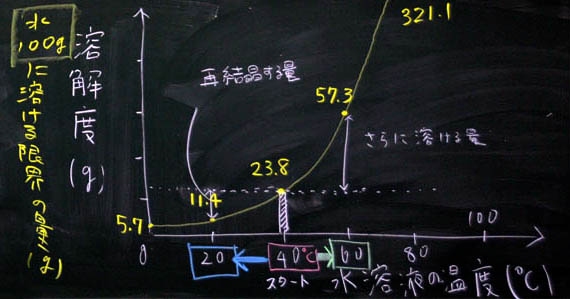
「ほう、やっぱりミョウバンを使っていますね。20度C、40度C、60度C、お手軽な温度で、お手軽なグラムになっています。いかにもテスト問題になりそうなグラフですね。では、これを丸写しすることにしましょう。」
「グラフのポイントは軸です。横軸は何ですか? ・・・そうですね。水溶液の温度(度C)です。では、学習プリントに書いてください。・・・次に、縦軸は何ですか? ・・・おっと、これは難しそうなので、福地オリジナルにします。まず、溶解度(g)と書いてください。テスト問題では、何グラムか読み取ることになるので、グラムです。しかし、難しい問題の場合は、水の量が変化しています。通常は100gなのですが、50gになったり、200gになったりします。50gになれば半分、200gなら2倍です。50gは100gの半分、200gは100gの2倍だから難しいことはありませんが、テストに出題されるとかなり難しいものになります。ということで、水100gに対して、とうことが重要なので、それを書いておきましょう。すなわち、水100gに対する限界の量(g)。」

上:B組の板書
「軸ができたら、できたも同然です。20度Cのとき何gですか。F君、調べてください! ・・・はい、よろしい、11.4g。 次は40度Cのとき、Gさん! ・・・はいその通り、23.8g。 最後にH君、60度Cの時 ・・・ 正解、57.3gです。これを、1本のなだらかな曲線で結んでください。折れ線グラフは×です。本当は、21度C、22度C、23度、24度Cのデータをとるわけです。3つは、たった3つに過ぎないので、その中間にも無数の正しい値があることをイメージして、美しいなだらかな1本の直線を書いてください。それが科学的思考であり、科学的なセンスです。美しい曲線を描くことができる人は、科学的な人です。おっと、水温0度Cの時のグラムも書いておきましょう。さらに美しくなります。教科書と見ると、・・・、5.7グラムですね。」
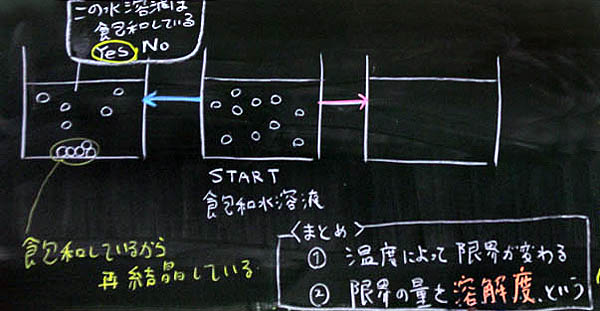
2) 前のモデル図と溶解度曲線を対応させる
「ここから、テスト問題のような説明に入りますが、実は、前に描いたモデル図と溶解度曲線は同じです。モデル図のスタートは40度C、それを冷やしたものは20度C、温めたものは60度Cです。冷やしたものは溶解度が低くなるから再結晶しますが、その量は、引き算で求めます。簡単すぎてびっくりですね。温めたものの溶解度はあがりますので、さらに溶けるようになります。その量は、やはり引き算です。これまたびっくりするほど簡単な引き算です。
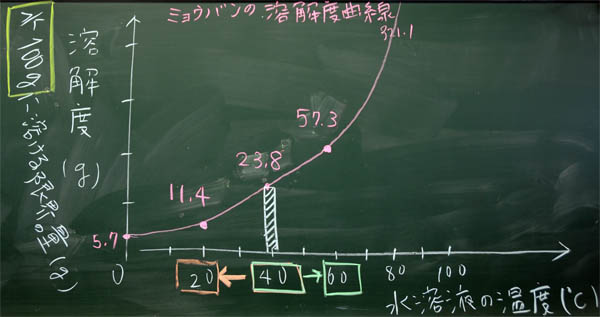
上:C組の板書
40度Cを中心に、冷やし(20度C ←)、温める(→ 60度C)
3) 冷やして、再結晶の量を計算する
4) 加熱して、さらに溶ける量を計算する
5) 計算のポイントをまとめる

上:C組の計算問題の板書
|