本時の目標
1 再結晶した食塩を観察・記録・スケッチ、および、採取・標本にする
2 再結晶の方法2つをまとめる
(問題プリントを使って、濃度と溶解度の問題が解けるようにする)
|
準 備
| 生 徒 |
教 師 |
|
|
- 本日の学習プリント (1/人)
- ルーペ
- ピンセット
- セロハンテープ
|
授業の流れ
(0) 各班のシャーレの準備
始業前、理科室に入ってきた生徒に、自分の班のシャーレを実験台中央に移動させます。その時、できるだけ静かに運ぶように指示しましょう。水面に浮いている食塩の結晶があるからです。揺すると沈んでしまいますが、なぜ、表面に結晶ができるのか科学的に考えるチャンスです。

上:視線を低くし、水面に浮いている結晶を観察する生徒
飽和食塩水の水が蒸発する場所は、その水面です。また、水面に小さな埃が入ることで、それが『核』になって再結晶するのではないか、と思われます。
(1) 本時の内容紹介 (1分)
(2) 食塩の再結晶の観察、スケッチ (10分)
生徒観察の時間を10分とります。長いように感じますが、生徒達は熱心に観察・記録・スケッチしていました。

上:前時の実験結果をまとめさせるための板書
指導のポイント
1:2つのシャーレを書き、放置前と放置後をスケッチさせる
2:放置前のシャーレは、無色透明の食塩の飽和水溶液
3:放置前後で、飽和食塩水の量に差をつける
4:放置後にできる食塩の結晶は、サイコロのような形
5:結晶の大きさ、結晶ができている場所も記録する |

上:2回観察させ、水がすべて蒸発したものを観察させる時の板書
指導のポイント
1:前の流れ図に追加し、3段階とする
2:もちろん、初めから3段階準備しておいても良い
1)
食塩の飽和水溶液 |
→ |
2)
水が半分蒸発したもの |
→ |
3)
水が完全に蒸発したもの |
|

上:熱心に観察する生徒達

上:実験台の上に置かれたシャーレとA君の学習プリント
食塩の採取・標本づくりのポイント
1:できるだけ大きくて形の良い、無色透明ものを選ぶ
2:水中(食塩の飽和水溶液中)にあるものでも良い
3:空気中の水分で形が溶けることがあので、セロハンテープで密閉する
4:密閉したものを学習プリントに添付する |

上:完全に水が蒸発したものの中から結晶を選び、学習プリントに添付する生徒

上:ルーペを使って観察する生徒

上:学習プリントに添付した結晶を再観察する生徒

上:蒸発速度が早く、結晶の形がよくない班
|
再結晶の条件
写真上は、直射日光があたる窓際だったからだろうか。水が一気に蒸発し、結晶が成長しなかったように見える。不純物がたくさん入っていた可能性も高いし、シャーレに入れた食塩水の量が多過ぎる可能性もある。さて、この実験はかなり適当だったが、今回の条件と結果は以下の通り。
初めに入れた飽和水溶液の量は、シャーレ半分〜7割。多過ぎると食塩どうしがひっつくので、半分以下の方が良いと思う。10月中旬の名古屋市の理科室に放置。晴れた日なら1日で直径1mmのものが大量に生じ、5日で完全に水が蒸発する。
|
(3) 食塩が再結晶した理由 (2分)
「食塩はどうして再結晶したのですか?」と生徒に発問すれば、何人かが正しく説明してくれるでしょう。代表的な考えは以下の通りです。
水は蒸発するが、食塩は蒸発できない
↓
食塩が再結晶する
(初めの水溶液は限界状態、飽和状態だったから)
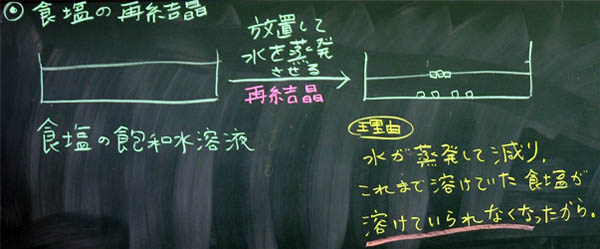
上:A組の板書
(4) 水溶液に溶けている溶質を再結晶させる2つの方法 (7分)
水溶液に溶けている溶質を再結晶させる方法は2つあります。1つは水を気化させる方法。もう1つは飽和水溶液を冷やす方法です。

上:B組の板書
再結晶についてまとめてから、その方法について発問しました。生徒の意見は上の3つでした。最後の『ろ過』は違いますが、全てのクラスで同じ意見が出ました。これは再結晶との違いが明確になるので、とても役立つ間違いでした。ろ過で取り出せるものは、沈殿物、あるいは、再結晶した固体です。
なお、黒板に『蒸発(気化)』と書いたものは、正確には『気化』です。水溶液を沸騰(気化)させても良いからです。

上:A組の板書
(5) テスト対策
残り時間は、テスト対策の問題練習を行いました。
◎ 生徒の学習プリント
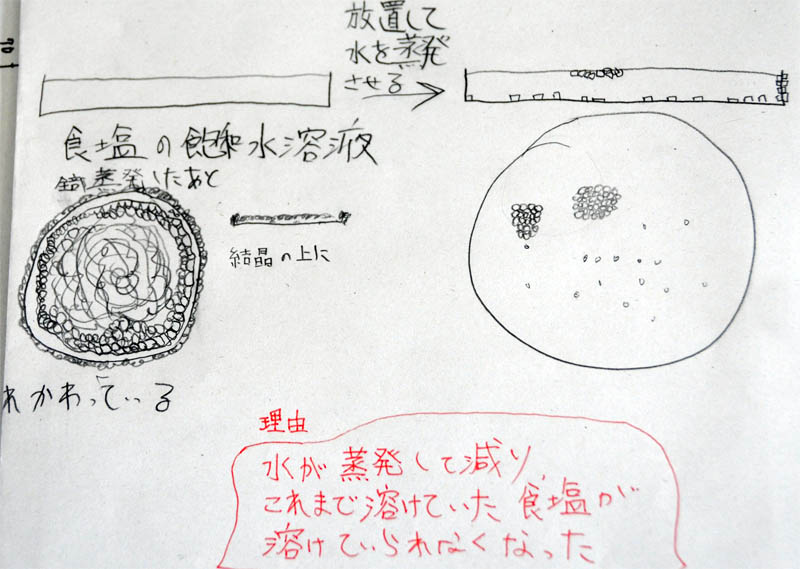
上:C君の学習プリント
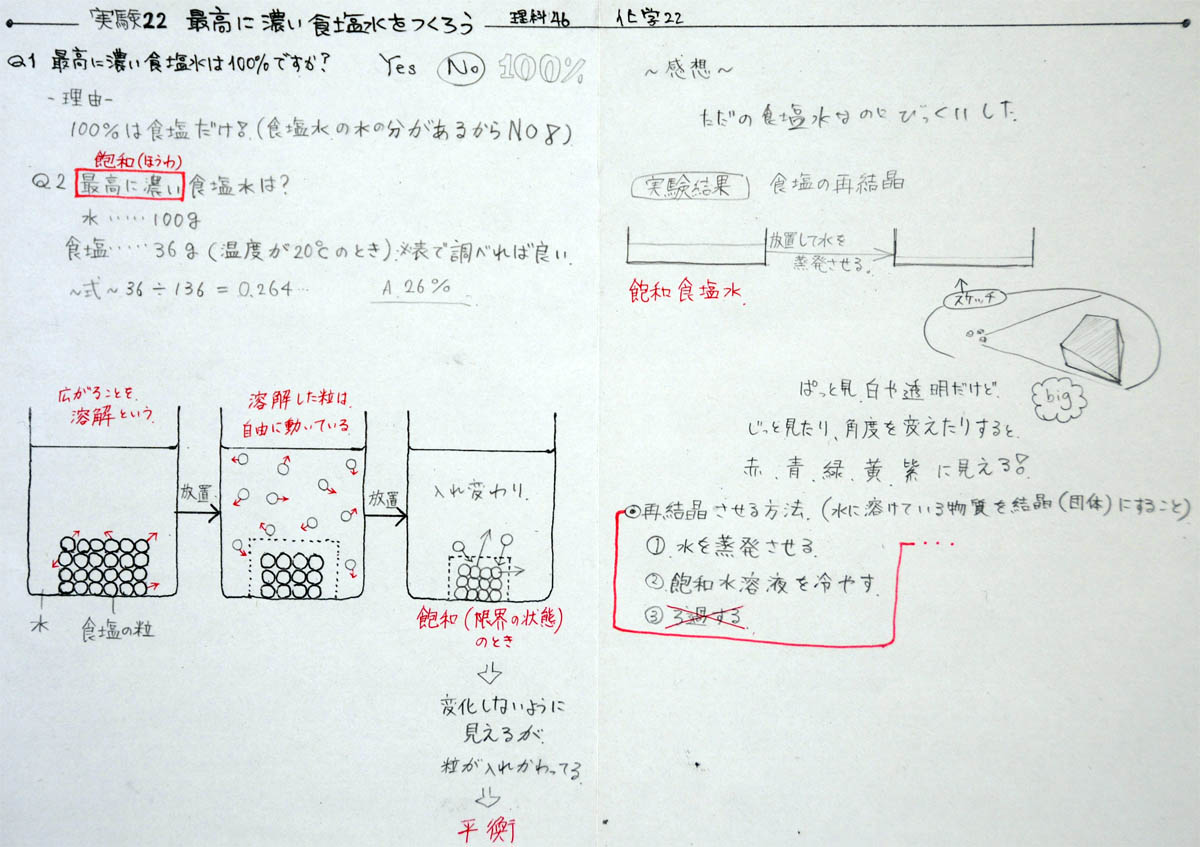 |
. |
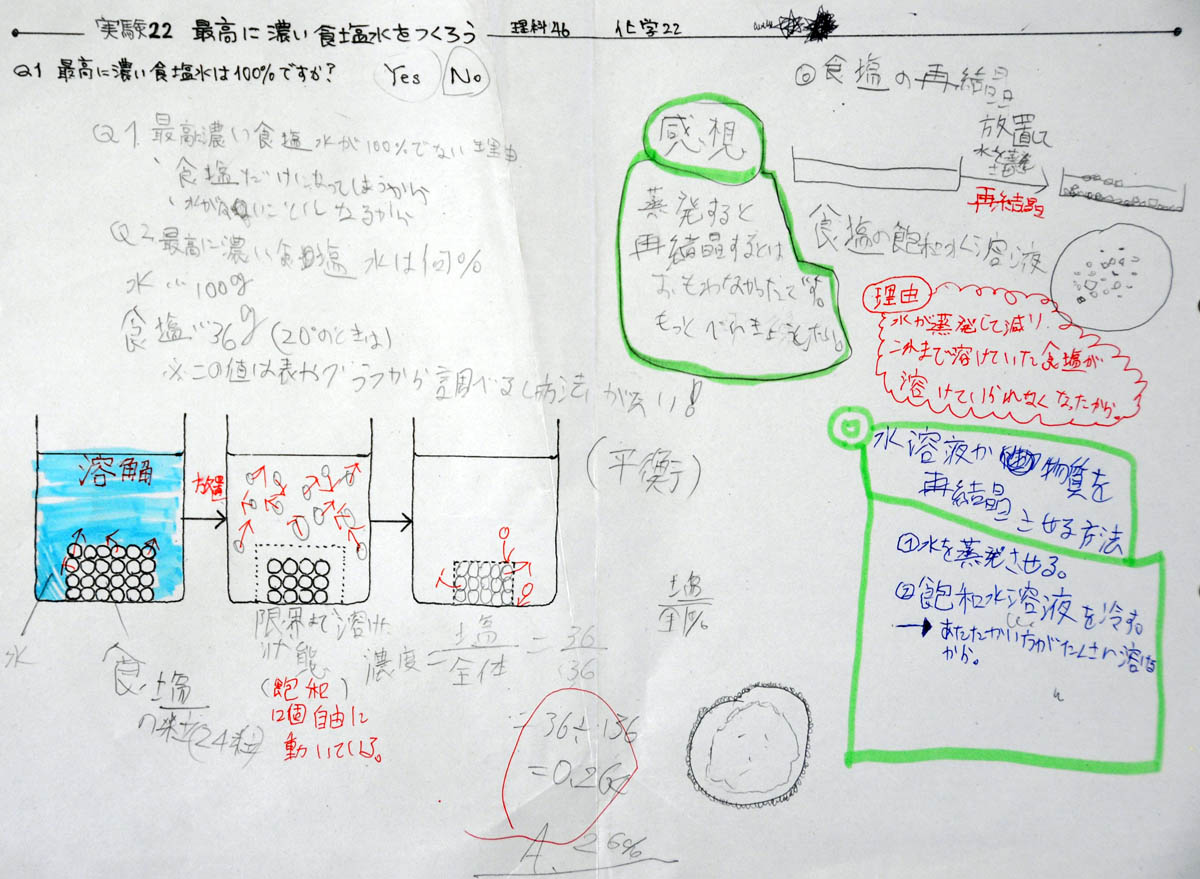 |
上2枚:D君とE君の学習プリント(クリックすると拡大)















