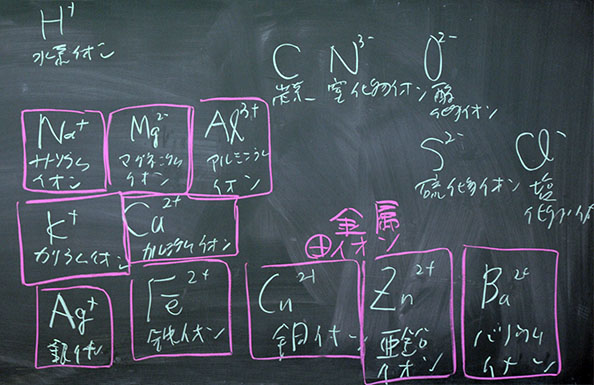第57時
実習4 原子のイオン化(電子配置)
2018 10 22(月)、23(火)
普通教室
はじめに
電子の数は原子番号と、同じです。1番『水素』の電子は1個、2番『ヘリウム』は2個、3番『リチウム』は3個、・・・です。ここまでは、わざわざ確認しなくても常識として納得できることでしょう。本日は『電子の位置』を追加します。電子は、原子核の周りを飛んでいますが、その位置と数が決まっています。
原子核にもっとも近い位置で飛べる電子は2個までです。3個めは、その次の高さ(遠い位置)になります。4個め・5個め・6個め・7個め・8個め・9個め・10個めも同じ位置ですが、11個めは違います。もう1段階高い高さ(3番めの位置)になります。
つまり、一番内側は2個、その次は8個、その次も8個までです。この規則性を紹介してから、電子配置が安定するように電子が出入りする(イオン化する)ことを示します。

図1: イオンの電子配置(クリックすると拡大します)
本時の目標
・原子番号20番までのイオンのモデル図を、電子配置に注意して描けるようにする
・最外殻電子の数を2、または、8にすることで、電子配置が安定することを理解する
・電子配置を安定させるために、電子が出入りすることを理解する
・電子を出すと+、もらうと−になることを理解する
|
準 備
| 生 徒 |
教 師 |
|
- 本日の学習プリント(1 /人)
- イオン周期表練習用紙(1 /人)
|
授業の流れ
(1)本時の授業内容の紹介 (1分)
(2)イオン周期表の小テスト(5分〜10分)
今日から4時間連続して、イオン周期表(taka先生の造語)の小テストを行います。今回はその初日です。小テストに当たって、周期表の枠を印刷したA3用紙を配布します。片面4つ、両面で8つの枠を印刷したものです。家庭練習用紙としての役割も兼ねています。
小テスト連続を宣言することで、とにかく暗記しなければならないことを示します。そして、連続4回の授業で、暗記するための鍵や規則性を深めていきます。前時は『イオンの紹介』でしたが、本時は『イオンの電子配置の規則性』を学習します。
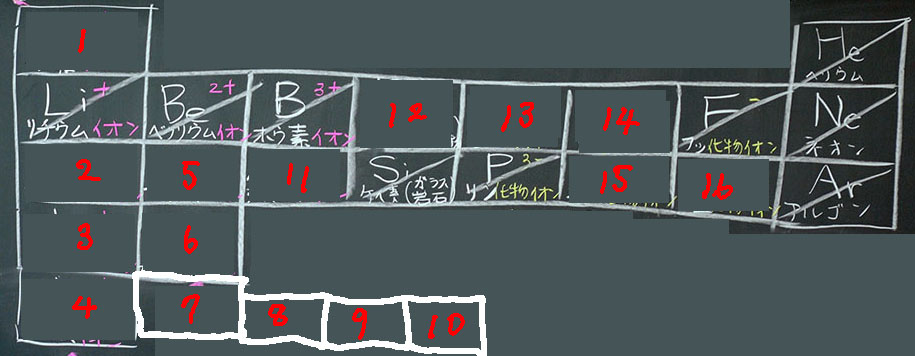
図2:16点満点の小テスト
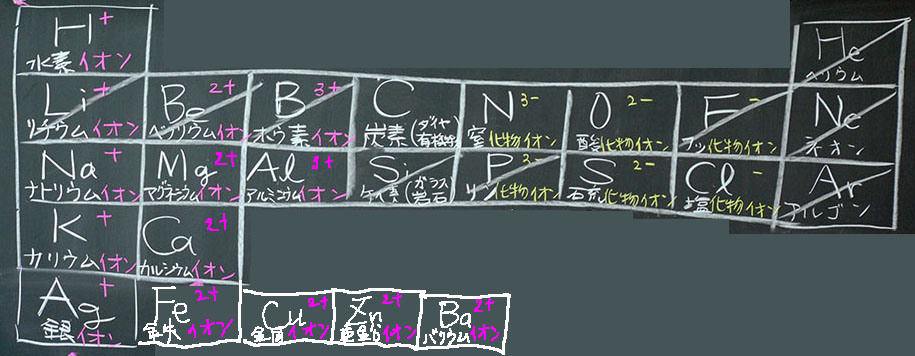
図3:小テストの解答
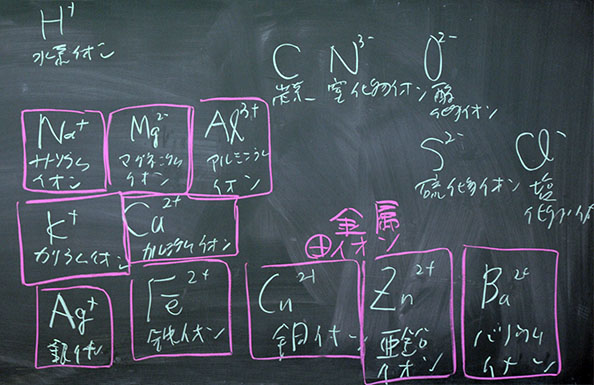
図4:小テストの解答の解説
金属原子はすべて+イオンになる、ことを付け加えました。
(3)20番までの原子がイオン化したときの電子位置(15分〜25分)
原子番号1番から順に、ゆっくりモデル図を書いていきます。
モデル図を描く手順
1)原子核を描く
2)原子核に番号1〜20を描く
3)水素原子に、電子1個を描く
4)ヘリウム原子に、電子2個を描く
→ 電子2個は、同じ軌道
5)チリウム原子に、電子3個を描く
→ 3個めの電子は、外側に軌道を書いて、そこに描く

図5:上記1)〜5)までの板書
�6)ベリリウム原子に、電子4個を描く
以降、省略

図6:完成した電子配置図
|

図:完成した電子配置図(B組)
最外殻電子の過不足によって、電気量が決まります。基準となる最外殻電子の数は、以下の通りです。
基準となる最外殻電子の数
| 原子番号(原子名) |
最外殻
電子数 |
型 |
| 1番(水素)〜5番(ベリリウム) |
2 |
ヘリウム |
| 6番(炭素) |
2(8) |
ヘリウム(ネオン) |
| 7番(窒素)〜13番(アルミニウム) |
8 |
ネオン |
| 14番(ケイ素) |
8 |
ネオン(アルゴン) |
| 15番(リン)〜20番(カルシウム) |
- |
アルゴン |
上記内容については、説明しません。 |
(6)本時の感想、考察 (5分)
授業を終えて
最外殻電子の位置をどこにするか、学級によってまちまちになってしまいました。いまだ、迷っているところです。
関連ページ
原子の構造(3年)2011年
原子の大きさ(2年)2003年
実践ビジュアル教科書『中学理科の化学』
↑ TOP
[→home]
(C) 2018 Fukuchi Takahiro