第58時
実習5 原子の構造
2018 10 23(火)、24(水)
普通教室
はじめに
前時は、『原子は中心にある原子核とその周りを飛ぶ電子からできていること』、さらに、『電子が飛ぶ軌道は決まっていること』、さらに、『最外殻電子の数を安定させるために電子を出したりもらったりする結果、イオンになること』を学びました。
本時は電子から離れ、原子核の内部の構造について学習します。※本時のタイトル『原子の構造』は、『原子核の構造』とした方が適切だったかも知れない。
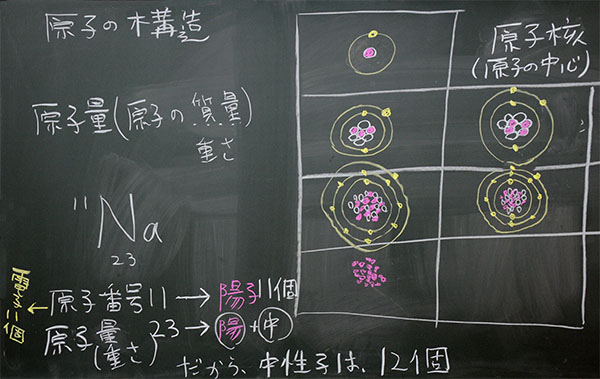
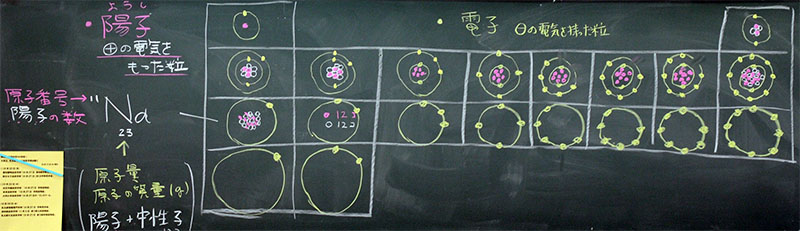
原子核には『+の電気を帯びた陽子』と『電気を持たない中性子』という、2つの粒子があります。陽子数は、原子番号と同じです。例えば、水素は1個、ヘリウムは2個、リチウムは3個、・・・、ウラン92個です。自然界において、陽子の数が最も多い原子核はウランであり、陽子は92個です。したがって、自然界における元素(エレメント)は92種類になります。元素という言葉を突然使いましたが、元素と原子を区別します。自然界における元素は92種類ですが、原子は3000種類ほど存在します。
なぜ、原子が3000種類になるのでしょう。理由は<中性子の数が違うから>です。陽子の数は同じでも、中性子の数はいろいろあるのです。それらを同位体(アイソトープ)といいます。
例えば、自然界における水素の同位体は3つです。私たちが『水素』といっているものは陽子1個・中性子0個の軽水素で、自然界における割合は99.99%です。その他、ごくわずかに重水素(陽子1個・中性子1個)と三重水素(陽子1個・中性子2個)のものがあります。実験室では四重水素、五重水素、・・・と無限につくることが可能ですが、それらはすぐに自然崩壊します。いわゆる核分裂を起こします。
『水素原子は3種類ある』と言い切りましたが、軽水素99.99%という事実を常識的に判断すると、『水素原子は1種類』になります。この常識レベルで考えるなら、元素と原子という言葉を区別する必要はありません。
原子(原子核)の質量(g、グラム)
原子の質量は、原子核(陽子•中性子)と電子の合計になります。しかし、それらの質量を比較すると、電子は無視できるほど小さいので、原子の質量=原子核の質量、と考えることができます。陽子と中性子の質量は、ほぼ同じです。したがって、原子の質量は、陽子と中性子の合計、となります。原子の質量は原子量、といいます。
参考・関連ページ
原子の構造(3年)2011年
原子の大きさ(2年)2003年
図1:ナトリウムの原子番号(陽子)、原子量(陽子+中性子)、電子