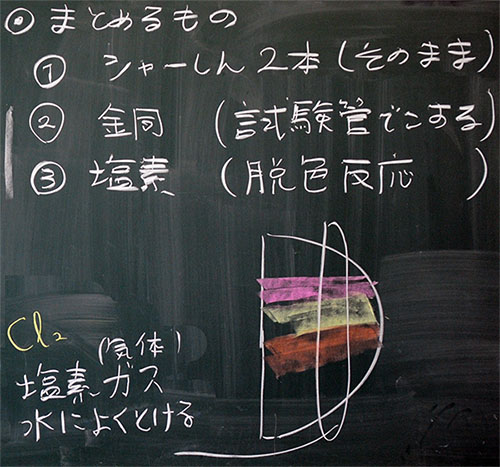本時の目標
・塩化銅の電離式とそのモデル図を理解する
・塩化銅の電気分解の化学反応式とそのモデル図を理解する
・塩素の脱色反応、および、銅の金属光沢を確認する
|
準 備
| 生 徒 |
教 師 |
|
- 本日の学習プリント(1 /人)
- 塩化銅 (1g /2人)
- 50mLビーカー(1 /2人)
- ガラス棒(1 /2人)
- 50cmリード線 (2/2人)
- 炭素棒 (2/2人)
- ろ 紙 (1/人)
- 試験管 (1/1人)
- 電源装置(1 /2組)
- セロハンテープ(1 /2組)
- 実物投影機 & モニター
|
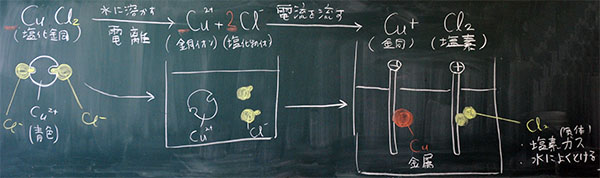
図2:実験を2つのステップに分ける
まず、水に溶かす(電離させる)、次に、電流を流す(電気分解する)
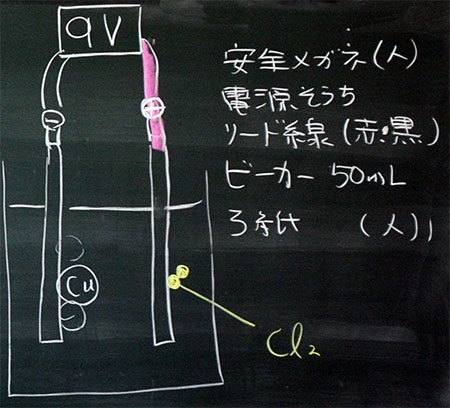
図3:電気分解のモデル図、始業前に準備するもの
2ステップの化学反応式とそのモデル図をかけた人から、実験に必要なものの準備を開始します。
図3の右にあるものは始業前に準備するものです。

図4:本日の化学反応式(モデル図)、銅と塩素の性質、結果のまとめ方

図5:シャー芯を使った電気分解

図6:同上
電気分解が進むと、塩化銅水溶液の色がなくなり、無色透明になってきます。『銅イオンは青色』であることを教えてあるので、銅の析出によって色がなくなることは、簡単に予測できます。

図7:ろ紙の上に取った銅
図7では銅がうまく取れず、シャー芯もボロボロになっています。実は、シャー芯製造会社によって、その成分が違います。主原料はカーボン(炭素)ですが、粘土や糊などの含有量が違うのです。図7の芯は、粘土の量が多いのでしょう。下図9を見てください。プラス極とマイナス極に使用した芯を添付してありますが、あまり変化していません。カーボンだけでできている製品もあるようです。

図8:A君の学習プリントに添付られたシャー芯、ろ紙

図9:ほとんど変化していないシャー芯

図10:炭素棒による電気分解
炭素棒を使うと、図10のように黒いリード線をつけた−極で銅がたくさん析出します。赤いリード線をつけた+極では、炭素棒に小さなつぶつぶの気体が発生していることがわかります。これが塩素です。プールの消毒液のようなにおいがします。
このあたりで、学習プリントにまとめる内容を板書します(図11)。
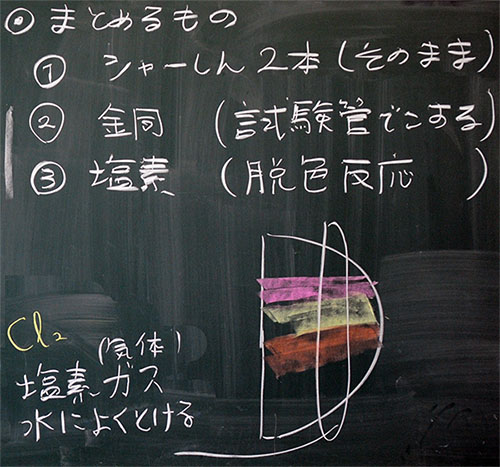
図11:学習プリントにまとめる内容

図12:塩素による脱色反応
右端の赤がよく脱色しています。

図13:採取した銅を試験管の底でこすったもの

図14:シャー芯2本なら、スピードも2倍